(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示__________, K值大小与温度的关系是:温度升高,K值_________________。(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g) +H2O(g)  CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。
CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。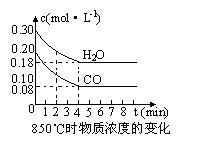
T℃时物质浓度(mol·L-1)的变化:
| 时间(min) |
CO |
H2 |
CO |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
3 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
|
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min~4min之间反应处于_________状态; c 1数值_________0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________ (单选),表中5min~6min之间数值发生变化,可能的原因是_________ (单选)。
a.增加水蒸气 b.降低温度  c.使用催化剂 d.增加氢气浓度
c.使用催化剂 d.增加氢气浓度
已知常温下D、E、F、H、L、N均为气体;A的焰色反应呈黄色;向B的溶液中滴加KSCN溶液,无明显现象;1 mol B隔绝空气分解得到F、G、H三种氧化物,其物质的量均为1 mol;F是易与血红蛋白结合的物质;J是现代社会中应用最广泛的金属单质。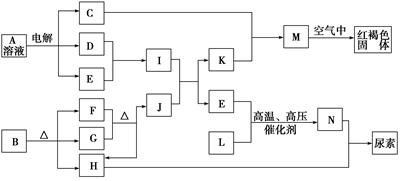
请回答下列题:
(1)B的化学式为________;H的结构式为________
(2)电解A溶液的离子方程式为______________________________________
(3)D与E反应可制得一种重要的化工原料,其反应的现象是____________________________
(4)F与G反应的化学方程式为________________________________
常温下,向含有H2SO4的CuSO4溶液中逐滴加入含a mol
溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述错误的是( )
| A.反应后溶液中c(Na+)=2c(SO42—) |
| B.a/2 mol>沉淀的物质的量>0 |
| C.沉淀的质量为49 a g |
| D.溶液中n(SO42—)=a/2 mol |
铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2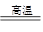 2PbO+2SO2;③制粗铅:PbO+C
2PbO+2SO2;③制粗铅:PbO+C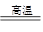 Pb+CO↑;PbO+CO
Pb+CO↑;PbO+CO Pb+CO2。
Pb+CO2。
下列说法正确的是( )
| A.浮选法富集方铅矿的过程属于化学变化 |
| B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO |
| C.整个冶炼过程中,制取1 mol Pb共转移2 mol电子 |
| D.将l mol PbS完全冶炼成Pb理论上至少需要6 g碳 |
稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。
已知:①铈常见的化合价为+3和+4;②氧化性:Ce4+>Fe3+。下列说法正确的是( )
A.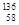 Ce、 Ce、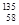 Ce、 Ce、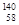 Ce、 Ce、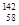 Ce它们互称为同素异形体 Ce它们互称为同素异形体 |
| B.工业上可以采用电解氯化铈水溶液来获得铈单质 |
| C.铈溶于氢碘酸的主要化学方程式可表示为2Ce+6HI=2CeI3+3H2↑ |
| D.工业上金属铈一般保存在敞口容器中 |
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。
另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为( )
| A.22.1 g | B.27.2 g |
| C.30 g | D.无法计算 |