已知丙酮与柠檬醛在一定条件下反应可以合成假紫罗兰酮,再进一步可以合成有工业价值的紫罗兰酮,如:
下图是合成有机物A的路线图,反应条件和一些不必列出的产物等均已删去。
(1)⑥中官能团的名称是 。
(2)写出结构简式② ⑤ ⑥ 。
(3)写出化学方程式①→② ,反应类型 ;
⑤→⑥ ,反应类型 。
(4)⑤的某种同分异构体符合下列条件,写出所有可能的结构简式 。
a.无支链 b.能发生银镜反应 c.核磁共振氢谱有四组吸收峰
用 分别滴定
分别滴定 和
和 ,滴定过程中
,滴定过程中 变化曲线如下图所示。
变化曲线如下图所示。
请回答:
(1)滴定盐酸的 变化曲线为(填“图1”或“图2”),判断的理由是
变化曲线为(填“图1”或“图2”),判断的理由是
。
(2)滴定 溶液的过程中,
溶液的过程中,
①当滴加 后,溶液中离子浓度由大到小的顺序为.
后,溶液中离子浓度由大到小的顺序为.
②当 时,溶液
时,溶液 7(填“>”、“=”或“<”)。
7(填“>”、“=”或“<”)。
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。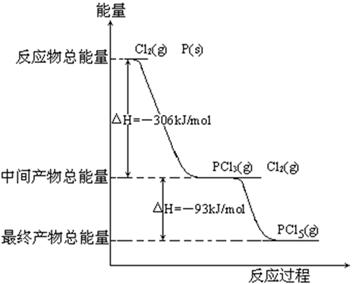
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式_________________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式_________________________________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于_________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2_______α1(填“大于”、“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是___________________________________。
(4)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_____________________。
发射卫星时可用肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:N2(g) +2 O2(g) = 2NO2(g);△H=+67.7kJ·mol-1
N2H4(g) + O2(g) = N2(g) + 2H2O(g);△H=-534kJ·mol-1
1/2H2(g) + 1/2F2(g) = HF(g);△H=-269kJ·mol-1
H2(g) + 1/2O2(g) = H2O(g);△H=-242kJ·mol-1
(1)肼和二氧化氮反应的热化学方程式为;此反应用于火箭推进,除释放大量能量和快速产生气体外,还有一个很大的优点是:__________。
(2)有人认为若用氟气代替二氧化氮作氧化剂,则反应释放的能量更大。肼和氟气反应的热化学方程式为 ___。
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由。
已知: A是石油裂解气的主要成份且A的产量通常用来衡量一个国家的石油化工水平;请回答下列问题:
(1)写出A的结构简式。
(2)写出下列反应的反应类型:①,④。
(3)写出下列反应的化学方程式:
①;②;
③;⑤。