下列各溶液中,微粒的物质的量浓度关系正确的是
A.等体积、等物质的量浓度的CH3COONa与CH3COOH溶液混合:
2c(Na+)=c(CH3COO-)+c(CH3COOH)
B.0.1mol/L pH为10的NaHB溶液中:c(HB-)>c(B2-)>c(H2B)
C.常温下,将pH=10的NaOH溶液和pH=4的CH3COOH溶液等体积混合:
c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
D.等物质的量浓度的(NH4)2SO4和(NH4)2CO3溶液中的c( ):前者<后者
):前者<后者
下列物质性质的变化规律与分子间作用力有关的是()
| A.HF、HCl、HBr、HI的热稳定性依次减弱 |
| B.金刚石的硬度大于硅,其熔、沸点也高于硅 |
| C.NaF、NaCl、NaBr、Nal的熔点依次降低 |
| D.F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
下列说法正确的是()
| A.任何一个能层最多只有s、p、d、f四个能级 |
| B.用n表示能层序数,则每一能层最多容纳电子数为2n2 |
| C.核外电子的运动的概率分布图(电子云)就是原子轨道 |
| D.电子的运动状态可从能层、能级、轨道3个方面进行描述 |
已知某金属单质晶体中(如碱金属)原子堆积方式如下图所示,则该堆积方式是()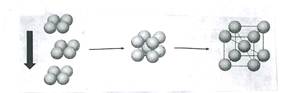
| A.简单立方堆积 | B.体心立方堆积 |
| C.六方最密堆积 | D.面心立方最密堆积 |
下列关于金属的叙述中不正确的是()
| A.金属键是金属阳离子和自由电子这两种带异性电荷的微粒间的强烈相互作用,所以实质与离子键类似,也是一种电性作用 |
| B.金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似,也有方向性和饱和性 |
| C.金属键是带异性电荷的金属阳离子和自由电子间的相互作用,故金属键无饱和性和方向性 |
| D.构成金属的自由电子在整个金属内部的三维空间中做自由运动 |
下列各组原子,彼此性质一定相似的是()
| A.1s2与2s2的元素 |
| B.M层上有2个电子与N层上有2个电子的元素 |
| C.2P上有一个未成对电子与3P上有一个未成对电子的元素 |
| D.L层上有一个空轨道和M层的P轨道上有一个空轨道的元素 |