物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度
有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液由于浓度不同而能发生不同氧化还原反应的是
| A.①③ | B.③④ | C.①② | D.①③④ |
已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
| A.H2O(g)=H2(g)+1/2 O2(g); △H= +242kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(l); △H= -484kJ·mol-1 |
| C.H2(g)+1/2 O2(g)=H2O(g); △H= +242kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(g); △H= -242kJ·mol-1 |
已知丙酮通常是无色液体,不溶于水 ,密度小于1g/cm3,,沸点55℃,从水与丙酮的混合物中将丙酮分离出来,下列方法中最合理的是
| A.蒸馏 | B.分液 | C.过滤 | D.蒸发 |
下列说法正确的是
| A.相对分子质量相同的几种化合物互称为同分异构体 |
| B.可用酒精从碘水中萃取碘 |
C.甲基的电子式: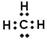 |
| D.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
为《京都议定书》2012年第一承诺期到期后的温室气体减排问题,世界各国都做出了不同的努力。随着新能源的开发和利用,CH3OH这个物质逐渐进入人们的视野,越来越受到人们的关注。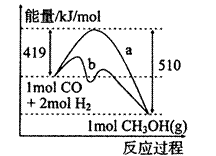
(1)下图是由CO(g)+2H2(g)→CH3OH(g)进行过程中的能量变化曲线。曲线a表示不使用催化剂时反应的能量变化,曲线b表示。下列相关说法正确的是()
A.该反应是吸热反应
B.使用催化剂后反应热减小
C.热化学方程式为CO(g)+2H2(g)CH3OH(g)△H=-510kJ/mol
(2)由(1)推断,CO(g)+2H2(g) CH3OH(g)在密闭容器中进行,图中曲线a代表一定条件下该反应的过程。若使a曲线变为b曲线,可采取的措施是()
CH3OH(g)在密闭容器中进行,图中曲线a代表一定条件下该反应的过程。若使a曲线变为b曲线,可采取的措施是()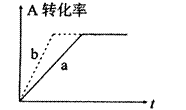
A.增大CO的浓度 B.缩小容器的容积
C.加入催化剂 D.升高温度
(3)由甲醇和氧气以及强碱做电解质溶液的新型燃料电池,正在逐步推广使用,假定放电过程中,甲醇完全氧化产生二氧化碳被充分吸收生成CO32-。该电池的负极反应的离子方程式为,放电过程中电池里溶液的pH将(填“下降”、“上升”或“不变”);若有16克甲醇被完全氧化产生电能,并利用该过程中释放的电能电解足量的硫酸铜溶液,假设能量的利用率为80%。则得到氧气的物质的量是。
(4)某同学将甲醇完全燃烧生成CO2气体通入200mL 0.1 mol/L的石灰水后,得到lg沉淀,那么通入的CO2的体积可能为(标态)。
在298K 1.0l×l05Pa下,将32g SO2通入750mL 1mol/L KOH溶液中充分反应.测得反应放出xkJ的热量。已知在该条件下,lmol SO2通入1 L 2mol/L KOH溶液中充分反应放出ykJ的热量。则SO2与KOH溶液反应生成KHSO3 的热化学方程式正确的是()
的热化学方程式正确的是()
| A.SO2(g)+KOH(aq)=KHSO3(aq)△H=-(4x-y)kJ/mol |
| B.SO2(g)+KOH(aq)=KHSO3(aq)△H=-(2x-y)kJ/mol |
| C.SO2(g)+KOH(aq)=KHSO3(aq)△H=-(2y-x)kJ/mol |
| D.2SO2(g)+2KOH(1)=2KHSO3(1)△H=-(8x-2y)kJ/mol |