(12分)图表法、图象法是常用的科学研究方法。请回答以下问题
(1)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。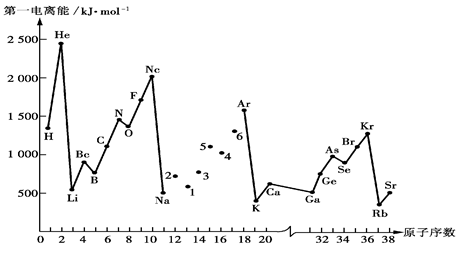
① 将Na—Ar之间六种元素用短线连接起来(不必写在答题卷上),构成完整的图像。从上图分析可知,同一主族元素原子的第一电离能I1变化规律是;__________________
_________________________________________________________________________
②上图折线中数字5代表元素在周期表中的位置是___________________________;
(2)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:试结合元素周期律知识完成下列问题:
| 元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
| X的数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
| 元素 |
Mg |
Na |
O |
P |
S |
Si |
|
| X的数值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
|
①经验规律告诉我们: 当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。
当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。
②某有机化合物分子中含有S—N键,你认为该共用电子对偏向于____________原子(填元素符号)。
(3) 已知:波长为300nm的紫外光的光子所具有的能量约为399 kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: _______________________________________________________________。
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。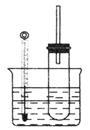
实验操作I:在试管中加入5mL1mol/LNaOH溶液和5mL溴乙烷,振荡。
实验操作Ⅱ:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是________________________。
(2)观察到___ _现象时,表明溴乙烷与NaOH溶液已完全反应,写出发生的反应方程式:
(3)鉴定生成物中乙醇的结构,可用的波谱是____________________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是______,检验的方法是____________(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
(1)在下列物质中是同系物的有___________;互为同分异构体的有___________,是同一种物质的有___________。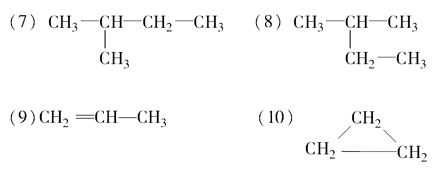
(11)2,2-二甲基丁烷
(2)具有复合官能团的复杂有机物,其官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论。
如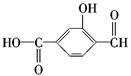 具有三种官能团:__________、__________和__________(填官能团的名称),所以这个化合物可看作__________类、__________类和__________类。
具有三种官能团:__________、__________和__________(填官能团的名称),所以这个化合物可看作__________类、__________类和__________类。
有机物A只由C、H、O三种元素组成,常用作有机合成的中间体,测得16.8 g该有机物经燃烧生成44.0 g CO2和14.4 g水。质谱图表明其相对分子质量为84;红外光谱分析表明A中含有—O—H和位于分子端的CCH,核磁共振氢谱显示有3种峰,且峰面积之比为6∶1∶1。
(1)写出A的分子式_________________;
(2)写出A的结构简式____________________;
(3)下列物质一定能与A发生反应的是____________________(填序号)
a.H2b.Na c.KMnO4d.Br2
(4)有机物B是A的同分异构体,1 mol B可以与1 mol Br2加成,该有机物的所有碳原子在同一平面上,核磁共振氢谱显示有3种峰,且峰面积之比为6∶1∶1,则B的结构简式是___________。
有9种微粒:
①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;⑧CH3+;⑨-CH3。
(1)上述9种微粒中,属于官能团的有(填序号)________。
(2)其中能跟-C2H5结合生成有机物分子的微粒有(填序号)__________。
(3)其中能跟C2H3+结合生成有机物分子的微粒有(填序号)__________。
用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯结构简式为______________________。
(2) 名称为___________________________。
名称为___________________________。
(3) 名称为___________________________________。
名称为___________________________________。
(4)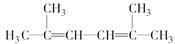 名称为___________________________。
名称为___________________________。