25℃时,用0.2mol/L HC1溶液滴定25mL 0.1mol/LNaOH溶液,右图是溶液的pH与加入HC1溶液的体积关系,图中Ⅰ、Ⅱ、Ⅲ分别代表实验不同阶段的溶液。下列有关说法不正确的是( )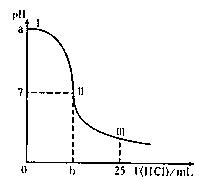
| A.图中Ⅰ点对应的纵坐标a=13 |
| B.图中Ⅱ点对应的横坐标b=12.5 |
| C.图中Ⅲ点所示溶液中:c(C1—)=2e(Na+) |
| D.图中Ⅱ、Ⅲ间的任意一点所示溶液中: |
c(Na+)>c(C1—)>c(H+)>c(OH—)
铀(U)常见化合价有+4价和+6价,硝酸铀酰[UO2(NO3)2]加热可发生如下反应:UO2(NO3)2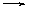 UxOy+NO2↑+O2↑(化学方程式未配平),在600 K时将气体产物集满试管,并倒扣水中,水充满试管。则上述分解反应生成的铀的氧化物化学式为
UxOy+NO2↑+O2↑(化学方程式未配平),在600 K时将气体产物集满试管,并倒扣水中,水充满试管。则上述分解反应生成的铀的氧化物化学式为
| A.UO2 | B.UO·UO3 | C.UO3 | D.UO2·2UO3 |
下列叙述中完全正确的一组是
①常温常压下,1 mol甲基(—CH3)所含的电子数为10NA
②由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.2NA
③在标准状况下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA
④常温常压下,16 g O3所含的原子数为NA
⑤1 mol C10H22分子中共价键总数为31 NA
⑥1 mol Cl2发生反应时,转移的电子数一定是2 NA
⑦标准状况下,22.4 L水中含分子数为NA
| A.①②③④⑤ | B.②④⑤⑥⑦ | C.②④⑤ | D.①②⑤ |
下列说法中不正确的是
| A.光导纤维和石英的主要成分都是二氧化硅 |
| B.遗弃的废旧电池、塑料袋、废纸、破布都会造成水污染 |
| C.苏丹红、谷氨酸钠(味精)、碳酸氢钠(小苏打)、亚硝酸钠、明矾等都是在食品加工或餐饮业中禁止使用或使用量要严加控制的物质 |
| D.纳米装饰材料是一种不会产生甲醛、芳香烃及氡等会造成居室污染的绿色产品 |
某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,且这四种离子Fe3+、SO42-、Al3+和M的物质的量之比为2:4:1:1,则M离子可能为下列中的()
| A.Na+ | B.I- | C.S2- | D.Cl- |
共价键、离子键和范德华力是粒子之间的三种作用力。下列晶体①Na2O2②SiO2③石墨④金刚石⑤NaCl⑥白磷中,含有两种作用力的是
| A.①②③ | B.①③⑥ | C.②④⑥ | D.①②③⑥ |