2,3-二氧呋喃是抗肿瘤药物的中间体,四氢呋喃是常用溶剂,它们可以通过下列反应流程来合成: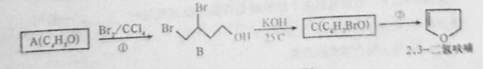
已知: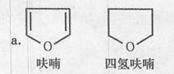
b.在碱存在的条件下,卤代烃可与酵发生如下反应:
R—X+R′—OH→R—O—R′+HX
请填写下列空白:
(1)化合物B的名称为 ;反应①的反应类型是 ;反应②的反应条件是 。
(2)写出结构简式:A为 ;C为 ;A与乙酸反应生成的酯为 。
(3)工业上可由二元醇D( C4H10O2)在一定条件下脱水制得四氢呋喃,该反应的化学方程式为 。
(4)写出满足下列条件的呋喃的一种同分异构体的结构简式 。
I.没有支链,且一元取代产物只有两种。
Ⅱ.不能与银氨溶液发生银镜反应。
Ⅲ.核磁共振氢谱图有2个峰,其面积之比为1:3。
(5)2,3—二氢呋喃在一定的条件下可以转变成四氢呋喃,如何用简单的化学方法检验2,3-二氢呋喃是否完全转化? 。
已知A、B、C、D、E是短周期中的5种非金属元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出元素符号:
A:, B:,C:_______,D:____。
(2)画出E的阴离子的结构示意图:。
(3)C的单质和D的单质在一定条件下反应生成化合物X,该反应的化学方程式为。
(4)A分别与其他四种元素形成的化合物,水溶液显碱性的是(写化学式)。
(5)将12 g B单质在足量的D单质中燃烧,所得气体通入1 L 1 mol·L-1NaOH溶液中发生反应,写出反应的离子方程式:。
Ⅰ.根据下列6种符号回答问题:
①1H ② 2 H ③ 3 H ④ 14C ⑤ 14N ⑥16O
(1)共有种核素,属于种元素。
(2)互为同位素的是。(填序号,下同)
(3)质量数相等的是,中子数相等的是。
Ⅱ.现有6种物质: ①MgCl2 ②HCl ③SO2④ K2CO3 ⑤ CaO ⑥ NaOH
请根据下列标准,对上述物质进行分类(填序号):
(1)属于共价化合物是。
(2)只含离子键的化合物是。
(3)含共价键的离子化合物是。
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族。已知D元素有两种常见的同素异形体,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质。
(1)A元素名称是C元素在周期表中的位置。
(2)A元素的单质与水反应的离子方程式是。
(3)写出C元素的单质从A、B两元素组成的化合物的水溶液中置换出B元素的单质的化学方程式。该反应能否说明C元素的非金属性比B强? __(填“能”“否”)
(4)BD2和C2的水溶液均具有漂白性,二者的漂白原理————。(填“相同”或“不同”)
(5)B元素的单质在不同的条件下可以与O2发生一系列反应:
B(s) + O2(g)=BO2(g)△H =-296.8kJ·mol-1
2BO2(s) + O2(g)  2BO3(g)△H =-196.6kJ·mol-1
2BO3(g)△H =-196.6kJ·mol-1
则1 mol BO3(g)若完全分解成B(s),反应过程中的反应热DH=。
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,负极材料是,以下说法中正确的是(填字母代号)
| A.①③ | B.②④ | C.①④ | D.②③ |
①以上反应是可逆反应②充电时镍元素被氧化
③电子由正极经电解质溶液流向负极④放电时电能转变为化学能
(2)写出放电时正极电极反应:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为;肼的结构式:
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4(l)反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4(1)△H1= -195kJ·mol-1
②N2H4(1) + O2(g)= N2(g) + 2H2O(g)△H2= -534.2kJ·mol-1
写出N2H4(1)和N2O4(1) 反应生成N2和水蒸气的热化学方程式;
(4)肼一空气燃料电池是一种具有高效,环境友好的碱性电池,,该电池放电时,负极的反应式为。