在一密闭容器中,反应mA(g)+nB(g) pC(g),达到平时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
pC(g),达到平时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
A.化学计量数:m + n < p B.平衡向逆反应方向移动了
C.物质B的转化率减小了 D.物质C的质量分数增加了
已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
| A.2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l)ΔH="-4b" kJ·mol-1 |
| B.C2H2(g)+5[]2O2(g)====2CO2(g)+H2O(l)ΔH="2b" kJ·mol-1 |
| C.2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l)ΔH="-2b" kJ·mol-1 |
| D.2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l)ΔH="b" kJ·mol-1 |
已知NaH2PO4溶液呈酸性,在水溶液中存在如下水解平衡:H2PO-4+H2O H3PO4+OH-,现将0.1 mol·L-1NaH2PO4溶液稀释后,增大的是( )
H3PO4+OH-,现将0.1 mol·L-1NaH2PO4溶液稀释后,增大的是( )
| A.[H+] | B.[OH-] | C.[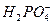 ] ] |
D.KW |
mA(s)+nB(g) pC(g)的可逆反应,在室温条件下φ(B)与压强(p)的关系如图4所示,则下列有关叙述正确的是( )
pC(g)的可逆反应,在室温条件下φ(B)与压强(p)的关系如图4所示,则下列有关叙述正确的是( )
图4
A.m+n<p
B.n>p
C.X点时混合物的正反应速率大于逆反应速率
D.X点比Y点混合物的反应速率慢
1 mol A气体与n mol B气体按下式反应生成气体C:A(g)+nB(g) mC(g),反应一段时间后,测得A的转化率是50%,此时气体的密度是反应前(同温同压)的4/3,则n和m的数值可能是( )
mC(g),反应一段时间后,测得A的转化率是50%,此时气体的密度是反应前(同温同压)的4/3,则n和m的数值可能是( )
| A.n="1,m=1" | B.n="3,m=3" | C.n="2,m=3" | D.n=3,m=2. |
下列对化学反应的表示正确的是( )
A.用铜作电极电解硫酸铜溶液的离子方程式:2Cu2++2H2O 4H++2Cu+O2↑ 4H++2Cu+O2↑ |
| B.含氢氧化钠20.0 g的稀溶液与足量盐酸反应放出28.7 kJ的热量,热化学方程式:NaOH(aq)+ HCl(aq)====NaCl(aq)+H2O(l)ΔH="-28.7" kJ·mol-1 |
C.碳酸氢钙溶液中加入过量饱和氢氧化钙溶液的离子方程式:Ca2++ +OH-====CaCO3↓+H2O +OH-====CaCO3↓+H2O |
D.稀硝酸与过量铁粉反应的离子方程式:3Fe+8H++2 ====3Fe3++2NO↑+4H2O ====3Fe3++2NO↑+4H2O |