Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。http://photo.blog.sina.com.cn/showpic.html - blogid=515359c40100g2jm&url=http://static1.photo.sina.com.cn/orignal/515359c4g79a02cb3d130&690http://photo.blog.sina.com.cn/showpic.html - blogid=515359c40100g2jm&url=http://static12.photo.sina.com.cn/orignal/515359c4g79a02bac230b&690
(1)完成以下实验设计表(表中不要留空格)。
| 实验 编号 |
实验目的 |
T/K |
pH |
c/10-3mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验作参照 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
|
|
|
|
| ③ |
|
298 |
10 |
6.0 |
0.30 |
[数据处理]实验测得p—CP的浓度随时间变化的关系如下图。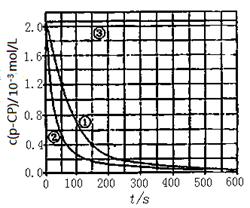
(2)请根据上图实验①曲线,计算降解反应在50~150s内的平均反应速率;v(p—CP)= mol·L-1·s-1。
[解释与结论]
(3)实验①、②表明温度升高,该降解反应速率增大。但温度过高时(如接近100℃)反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
(4)实验③得出的结论是:pH等于10时, 。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
(共14分)某研究性学习小组设计了一组实验,验证元素周期律。
(1)甲同学在a、b、c、d四只烧杯里分别加入50 mL冷水,再分别滴加几滴酚酞溶液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
①甲同学设计实验的目的是验证:同一主族,从上到下元素的元素金属性逐渐增强;同一周期,从左到右,元素金属性_____________________;
②反应最剧烈的烧杯里金属是_______(填字母)
A、钠 B、镁 C、铝 D、钾;
③写出a烧杯里发生反应的离子方程式。
④实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验的目的,请你帮助选择下列合适的方法。
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
(2)乙同学设计实验验证:非金属元素的非金属性越强,其最高价含氧酸的酸性就越强。他设计了下图装置以验证碳、氮、硅元素的非金属性强弱。乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,其浓溶液在常温下可与铜反应;B是块状固体;烧杯中盛放C的水溶液,打开分液漏斗的活塞后,C中可观察到白色胶状沉淀生成。
①写出所选用物质的化学式:A、; C、。
②写出烧瓶中发生反应的化学方程式:。
③碳、氮、硅三种元素的非金属性由强到弱顺序为。
如图是某同学设计的放热反应的观察装置,
其实验操作步骤如下:
①按图所示将实验装置连接好;
②在U形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;
③在盛有1.0g氧化钙的小试管里滴入2 mL左右的蒸馏水,观察现象。
试回答:
(1)实验前必须进行的一步实验操作是。
(2)实验中观察到的现象是。
(3)实验中发生的化学反应方程式:。
(4)说明CaO、H2O的能量与Ca(OH)2的能量之间的关系:。
(5)若该实验中CaO换成NaCl,实验还能否观察到相同现象?(填“能”或“否”)。
I.(9分)某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.50 mol·L-1 NaOH溶液、0.55 mol·L-1盐酸,实验尚缺少的玻璃仪器是。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否)。
(3)他们记录的实验数据如下:
| 实验用品 |
溶液温度 |
中和热 |
|||
| t1 |
t2 |
ΔH |
|||
| ① |
50 mL 0.50 mol·L-1 NaOH溶液 |
50 mL 0.55 mol·L-1 HCl溶液 |
20 ℃ |
23.2 ℃ |
|
| ② |
50 mL 0.50 mol·L-1 NaOH溶液 |
50 mL 0.55 mol·L-1 HCl溶液 |
20 ℃ |
23.4 ℃ |
已知:Q ="cm" Δt,c为4.18 J·℃-1·g-1,各溶液的密度均为1 g· cm-3。
①通过计算得到中和热ΔH =kJ/mol(保留一位小数)。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:。
(4)若用0.60 mol·L-1NaOH溶液代替0.50 mol·L-1NaOH溶液做实验,对测定结果(填“有”或“无”,下同)影响;若用0.55 mol·L-1醋酸代替0.55 mol·L-1盐酸做实验,对测定结果影响。
(5)计算结果发现本次实验测定值与正确值57.3 kJ/mol有偏差,产生偏差的原因可能是(填序号)操作。
①量取NaOH溶液的体积时仰视读数
②用温度计测定NaOH溶液的温度后直接测定盐酸的温度
③分多次把NaOH溶液倒入装盐酸的小烧杯中
II.甲、乙两同学拟定用pH试纸验证醋 酸是弱酸。方案分别是:
甲:①称取一定量的冰醋酸准确配制0.1mol/L的醋酸溶液100mL
②用pH试纸测出该溶液的pH,即可证明醋酸是弱酸。
乙:①称取一定量的冰醋酸准确配制pH=1的醋酸溶液100mL;
②取醋酸溶液10mL,加水稀释为100 mL;
③用pH试纸测出该溶液的pH,即可证明醋酸是弱酸。
(1)两个方案的第①步中,都要用到的定量仪器是。
(2)简要说明pH试纸的使用方法:。
(3)甲方案中,说明醋酸是弱酸的理由是测得醋酸溶液的pH1(选填“>”“<”“=”);乙方案中,说明醋酸是弱酸的理由是测得醋酸溶液的pH2(选填“>”“<”“=”)。
(4)请你也提出一个用pH试纸来证明醋酸是弱酸的合理且容易进行的方案(可以不再叙述pH试纸的使用方法,但叙述中应包括实验方法、现象和结论)。
某课外活动小组探究镁与CO2、NO2的反应。
I、实验发现点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体分别是C和MgO;该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测:写出Mg在NO2中燃烧的化学方程式。反应产生的固体中可能存在物质(填化学式)。
II、设计实验验证以上猜测(用于连接玻璃管的乳胶管均内衬锡纸)
资料信息:2NO2+ 2NaOH = NaNO3 + NaNO2 + H2O
(1)写出A中发生反应的化学方程式:;
(2)装置B中盛装的干燥剂是(填序号)___________________;
①浓硫酸 ②无水CaCl2 ③碱石灰
(3)实验开始时正确的操作步骤是___ ___;
a.打开A装置中分液漏斗的旋塞滴入浓硝酸制取NO2
b.打开活塞K
c.点燃C处酒精灯
d.当C处硬质玻璃管内充满红综色气体后,关闭活塞K
(4)D中NaOH溶液盛的很满,这样做的目的是____________ _____________;
(5)本实验中存在明显缺陷,改进措施是____________________________________。
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O ZnFe2(C2O4)3·6H2O↓(a)
ZnFe2(C2O4)3·6H2O↓(a)
ZnFe2(C2O4)3·6H2O  ZnFe2O4 + 2CO2↑+4CO↑+6H2O (b)
ZnFe2O4 + 2CO2↑+4CO↑+6H2O (b)
已知:ZnC2O4和FeC2O4难溶于水。
(1)上述制备原理中不属于氧化还原反应的是(选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ.(NH4)2Fe(SO4)2·6H2OⅡ.ZnSO4·7H2OⅢ.(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n (Zn2+)=。
②选用的加料方式是(填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,再升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成溶液乙,甲、乙同时加热到75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤完全的依据是。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。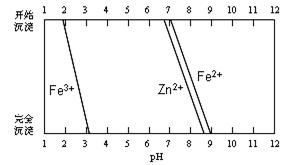
实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1稀硫酸,加入(选填字母,下同)。
A.30%H2O2 B.新制氯水 C.FeCl3溶液 D.KSCN溶液
②加入。
A.纯锌粉B.纯碳酸钙粉末C.纯ZnO粉末D.3mol·L-1稀硫酸
③加热到60℃左右并不断搅拌。
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是。