已知反应mX(g)+nY(g) qZ(g)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
| A.通入稀有气体使压强增大,平衡将正向移动 |
| B.X的正反应速率是Y的逆反应速率的m/n倍 |
| C.降低温度,混合气体的平均相对分子质量变小 |
| D.增加X的物质的量,Y的转化率降低 |
下表是常温下某些一元弱酸的电离常数:
| 弱酸 |
HCN |
HF |
CH3COOH |
HNO2 |
| 电离常数 |
4.9×10-10 |
7.2×10-4 |
1.8×10-5 |
6.4×10-6 |
则0.1 mol·L-1的下列溶液中,pH最小的是
A.HCNB.HFC.CH3COOHD.HNO2
在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH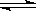 CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
把1 L 0.1 mol/L醋酸溶液用蒸馏水稀释到10 L,下列叙述正确的是
A.c(CH3COOH)变为原来的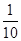 |
B.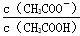 的比值增大 的比值增大 |
C.c(H+)变为原来的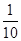 |
| D.溶液的导电性增强 |
用我们日常生活中的食用白醋(醋酸浓度约为1 mol·L-1)进行下列实验,能证明醋酸为弱电解质的是
| A.白醋中滴入石蕊试液呈红色 |
| B.白醋加入豆浆中有沉淀产生 |
| C.经检验白醋中c(H+)约为0.01 mol·L-1 |
| D.蛋壳浸泡在白醋中有气体放出 |
对下列物质:①H2SO4、②CO2、 ③NaOH、④BaSO4、 ⑤NH3、⑥SO2、 ⑦NH3·H2O、⑧C2H5OH、⑨Cu、⑩氯化钠溶液。按要求分类不正确的是
| A.电解质:①、③、④、⑦ |
| B.弱电解质:④、⑦ |
| C.非电解质:②、⑤、⑥、⑧ |
| D.强电解质:①、③、④ |