电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。有关反应为:2FeCl3+Cu=2FeCl2+CuCl2。
现将一块敷有铜箔的绝缘板浸入8.00×102 mL某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积变化)中取出20.00mL,向其中滴入
3.00mol • L-1AgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请计算:
(1)溶液A中FeCl3的物质的量浓度为___________________;
(2)假若铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于________________;
(3)讨论当剩余固体的组成不同时m与n可能的取值范围,并填入下表
| 剩余固体的组成 |
m的取值范围 |
n的取值范围 |
| 只有铜 |
|
|
| 有铁且有铜 |
|
(用含m的代数式表示) |
(共10分) W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
(1)写出元素名称:W_________,X________,Y________,Z_________;Z在元素周期表中的位置_________。
(2)Y2Z的电子式为_________;W2X2的结构式__________。
(3)两种均含四种元素的化合物相互反应放出气体的化学方程式是_______
(共6分)(1)已知CH4(g)+2O2 (g) = CO2 (g) +2H2O (l); △H=-890kJ/mol,现有CH4和CO共0.75mol,完全燃烧后生成CO2气体和18g液态水,并放出515kJ热量,则CO燃烧的热化学方程式为;
(2)化学反应N2+3H2 2NH3的能量变化如图所示,写出生成氨气时该反应的热化学方程式。
2NH3的能量变化如图所示,写出生成氨气时该反应的热化学方程式。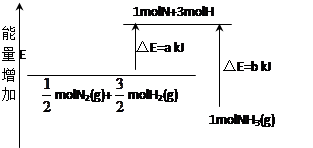
(共6分)某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学反应方程式为 ;
(2)反应开始至2minZ的平均反应速率为 ;
(3)若不改变外界条件,5min ~ 6min Z的生成速率(V1)与6min后Z的生成速率(V2)的大小关系为:V1 V2(填大于、小于或等于)。
(11分)A、B、C、D、E五种物质转化关系如图所示: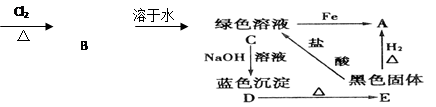
A(单质)棕黄色的烟
(1)确定A、B、C、D、E各为什么物质:(写出各物质的化学式)
A,B,C,D,E。
(2)写出下列各步反应的化学方程式:
E→A:
C→D:
E→C:
A→B:
(1)现有氧气、氮气、碳、铜、硫、铁、二氧化碳、氧化镁、水、氯酸钾、空气、碱式碳酸铜等物质,请根据要求填空。
①属于混合物的有,属于非金属氧化物的有。
②属于盐的有。
③含元素种类最多的化合物是。
(2)Fe(OH)3胶体中常混有FeCl3和HCl。将其装入半透膜袋,浸入蒸馏水中进行分离。
试回答:该分离方法称为。