某强酸性溶液X,含Ag+、Al3+、SiO2-3、NH+4、Fe2+、Fe3+、CO2-3、Cl-、NO-3中的一种或几种离子,取X溶液进行连续实验,能实现如下转化: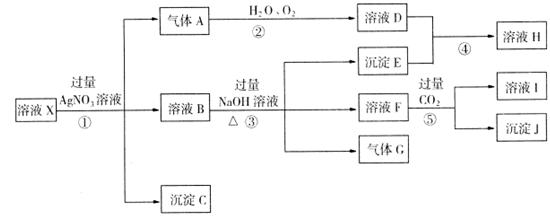
依据以上信息,回答下列问题:
(1)上述离子中,溶液x中肯定含有的是: ;不能肯定的是: ;对不能确定是否存在的离子,可以另取x溶液于一支试管中,选择下列试剂中的某一种加入X溶液,根据现象就可判断,则试剂可以选(若多种选法中间加“或"字间隔): 。
①酚酞试剂,②石蕊试剂,③pH试纸,④KSCN溶液,⑤KMnO4溶液,⑥苯酚溶液
(2)气体G的化学式为: ;沉淀E的化学式为: ;沉淀J的化学式为: 。
(3)实验中,产生的气体A为无色,但如果暴露在空气中可以观察到的现象是: ;写出步骤①中生成气体A的离子方程式 。
(4)要使步骤②中,A、H2O、O2三种物质恰好发生化合反应,则A、H2 O、O2物质的量之比是: 。
写出下列反应的离子方程式:
(1)用稀硫酸清洗铁锈(Fe2O3)___________________________________________ ___
___
(2)碳酸钠溶液与盐酸混合_________________________ ________________________
________________________
(3)硫酸铜溶液和氢氧化钡溶液混合____________________
(4)向足量澄清石灰水中通入二氧化碳_______________________________
(15)钢铁工业是国家工 业的基础,请回答钢铁腐蚀与防护过程中的有关问题。
业的基础,请回答钢铁腐蚀与防护过程中的有关问题。
(1)生产中可用盐酸来除铁锈。现将一生锈的铁片 放入
放入 盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式
盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式
________________________________________________________________________。
(2)下列哪个装置可防止铁棒被腐蚀__________________________________(填编号)。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图:
①A电极对应的金属是________(写元素名称),B电极的电极反应式是________。
②若电镀前A、B两金属片质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为________mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原 因
因
________________________________________________________________________。
某可逆反应的平衡常数表达式 ,恒容时,温度升高H2浓度减小。试回答
,恒容时,温度升高H2浓度减小。试回答 下列问题:
下列问题:
(1)该反应的化学方程式为: 。
。
(2)温度升高,该反应的K值______________(填“增大”“减小”或“不变”),化学平衡移动达到新的平衡后,CO2和CO体积比___________(填“增大”“减小”或“不变”)。
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生反应,CO和H2O浓度变化如下图。则 0—4min的平均反应速率v(CO)=___________ mol/(L·min),850℃的化学平衡 常数的值K=
常数的值K=
(4)850℃时,在相同容器中发生反应CO2+ H2 CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、 二氧化碳0.08 mol/L、氢气 0.08
CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、 二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时v(正)v(逆)(“大于”“ 小于”或“等于”)
mol/L,此时v(正)v(逆)(“大于”“ 小于”或“等于”)
同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(s,白磷)+5O2 (g)===P4O10(s) ΔH1=-2983.2 kJ·mol-1①
(g)===P4O10(s) ΔH1=-2983.2 kJ·mol-1①
P(s,红磷)+O2(g)===P4O10(s) ΔH2=-738.5 kJ·mol-1②
则白磷转化为红磷的热化学方程式为__________________。相同状况下 ,能量状态较低的是________;白磷的稳定性比红磷________(填“
,能量状态较低的是________;白磷的稳定性比红磷________(填“ 高”或“低”
高”或“低” )。
)。
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一 种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-,被还原成Mn2+ 。
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98ml
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作步骤依次是: 称量、__▲_____、转移、洗涤并转移、____▲____摇匀。
称量、__▲_____、转移、洗涤并转移、____▲____摇匀。
②加入锌粉的目的是___▲_____。
③写出步骤三中发生反应的离子方程式___▲_____。
④实验测得该晶体中铁的质量分数为_____▲____。在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量___▲____。(选填“偏低 ”“偏高”“不变”)
”“偏高”“不变”)
(2)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录 质量;计算结晶水含量。请纠正实验过程中的两处错误;___▲_____;_____▲____。
质量;计算结晶水含量。请纠正实验过程中的两处错误;___▲_____;_____▲____。