已知某待测液由Ag+、Mg2+、K+、Ba2+、NH4+、NO3-中的若干种离子组成,进行如下实验:
第一步: 加入过量的稀盐酸,有白色沉淀生成。
加入过量的稀盐酸,有白色沉淀生成。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:再过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试 纸变蓝色的气体。
纸变蓝色的气体。
根据实验现象回答:
(1)分别写出第二步和第三步中所涉及的反应的离子方程式:
第二步: ,
第三步: ;
(2)待测液中 一定含有 、NO3-离子,一定不含有 离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象及结论,不要求写实验操作过程) , 。
一定含有 、NO3-离子,一定不含有 离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象及结论,不要求写实验操作过程) , 。
甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料。甲醇在各个领域有着广泛的应用。
(1)实验测得:32 g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出726.4 kJ的热量,试写出甲醇燃烧的热化学方程式:_________________________。
(2)燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。下图是一个化学过程的示意图。2CH3OH+3O2+4KOH K2CO3+6H2O
K2CO3+6H2O
①A(石墨)电极的名称是 。
②通入O2的电极的电极反应式是________________
③写出通入CH3OH的电极的电极反应式是 。
④乙池中反应的化学方程式为 。
⑤当电路中通过0.01mol电子时,丙池溶液的C(H+) = mol/L(忽略电解过程中溶液体积的变化)。
(3)合成甲醇的主要反应是:2H2(g)+ CO(g) CH3OH(g) △H="—90.8" kJ·mol—1。
CH3OH(g) △H="—90.8" kJ·mol—1。
①在恒温恒容条件下,充入一定量的H2和CO,发生反应2H2(g)+ CO(g) CH3OH(g)。则该反应达到平衡状态的标志有
CH3OH(g)。则该反应达到平衡状态的标志有
a.混合气体的密度保持不变 b.混合气体的总压强保持不变
c.CO的质量分数保持不变 d.甲醇的浓度保持不变
e.v正(H2)= v逆(CH3OH)f.v(CO)= v(CH3OH)
②要提高反应2H2(g)+ CO(g) CH3OH(g)中CO的转化率,可以采取的措施是:
CH3OH(g)中CO的转化率,可以采取的措施是:
a.升温 b.加入催化剂
c.增加CO的浓度 d.加入H2
e.加入惰性气体 f.分离出甲醇
(14分)请回答下列问题:
(1)下表列出了一些化学键的键能E:
| 化学键 |
H—H |
O===O |
O—H |
| E/kJ·mol-1 |
436 |
x |
463 |
反应H2(g)+ O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
(2)铅蓄电池是正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质溶液是H2SO4溶液,电池放电时的总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
请写出充电时阴极的电极反应式:__________________
(3)反应m A+n B p C,在某温度下达到平衡。
p C,在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是________________。
②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向________________方向移动。
③若再升高温度,平衡向逆向移动,则正反应为 _________ 反应(填“吸热”或“放热”)
(4)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如图所示。
①请在图中标出电极材料及电解质溶液(写化学式)________________
②盐桥中的Cl-向________极移动(填“左”或“右”)。
金属铁是应用广泛,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取3.25g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用1.0 mol·L-1的盐酸中和滴定,正好中和时消耗盐酸60.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值:
(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.8,则该样品中FeCl3的物质的量分数为 。
(3)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,其中Zn极的电极反应式为 ,K2FeO4的电极反应式为 。
硫及其化合物在工业生产中有重要的应用,它们性质的研究对工业生产有重要的指导意义。
(1)2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。
2SO3(g),反应过程的能量变化如图所示。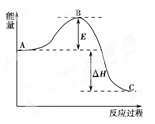
已知1 mol SO2(g)氧化为1 mol SO3(g)放出的热量为99 kJ。请回答下列问题:
①图中E表示_____________,E的大小对该反应的反应热有无影响?_______________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________,理由是_____________;
②图中ΔH=____________kJ·mol-1;
(2)下图表示在密闭容器中反应2SO2+O2 2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。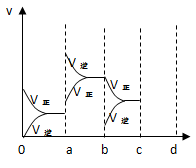
①a b过程中改变的条件可能是 ;
②b c过程中改变的条件可能是 ;
③若增大压强时,反应速率变化情况画在c~d处。
分,共反应mA+nB pC在某温度下达到平衡。
pC在某温度下达到平衡。
(1)若A、B、C都是气体,减压后v正小于v逆,则m、n、p的关系是______ 。
(2)若在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为___________态。
(3)若A为液体,C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向________(填“正反应”或“逆反应”)方向移动。
(4)若升高温度,A物质的转化率增大,则该反应为________(“吸热”或“放热”)反应。