某微粒的结构示意图为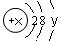 试回答:
试回答:
(1)当x-y=10时,该粒子为 (填“原子”或“阳离子”“阴离子”)
(2)当y=8时,该粒子可能是
(写名称): 、 、 、 、 。
(3)写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式 。
按要求完成下列问题。
(1)甲基的电子式
(2)通式为CnH2n+2的最简单同系物的分子式
(3)相对分子质量为72且沸点最低的烷烃的结构简式 _____________________
(4)1,3-丁二烯的键线式
现有100mL AlCl3与MgSO4的混合溶液,分成两等份。
(1)向其中一份中加入10mL 4mol/L的氨水,恰好完全反应,其中AlCl3与氨水反应的离子方程式是。继续加入l mol/L NaOH溶液至10mL时,沉淀不再减少,沉淀减少的离子方程式是,剩余的沉淀的物质的量是。
(2)向另一份中加入a mL 0.1mol/LBaCl2溶液能使SO42-沉淀完全,a=。
一个体重50 kg的健康人含铁元素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)经常进行Fe2+与Fe3+的转化,可表示为Fe2+ Fe3+。在过程A中,Fe2+作剂。
Fe3+。在过程A中,Fe2+作剂。
(2)维生素C可使食物中的Fe3+转化为Fe2+,维生素C在这个反应中具有性。
(3)某同学要检验Fe3+,向溶液中加入 (写化学式)溶液变成红色。要除去FeCl3溶液中少量的氯化亚铁,可行的办法是(填字母)。
a.加入铜粉 b.加入铁粉 c.通入氯气 d.加入NaOH溶液
根据选用的试剂,写出除去FeCl3溶液中少量的氯化亚铁过程中发生反应的离子方程式。
(4)电子工业常用30%的FeCl3 溶液腐蚀铜箔,制造印刷线路板,写出FeCl3 与金属铜反应的离子方程式 。
(5)使用过的腐蚀液会失效,但可以回收利用,某兴趣小组为了从使用过的腐蚀液中回收铜,应使用的试剂是(填字母)
a.铜粉 b.氯气 c.铁粉 d.KSCN溶液
“探险队员”——稀硫酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多与稀硫酸反应的物质,稀硫酸必须避开它们,否则就无法通过。
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)
________________。
(2)在不能与稀硫酸反应的物质中,属于电解质的是_______________(填写物质前的序号);在能与稀硫酸反应的化学反应中,属于氧化还原反应的是(写出反应的离子方程式)。
(3)稀硫酸遇到②Na2CO3时,若不能反应说明理由,若能反应写出反应的化学方程式。
在一容积为2L的密闭容器中,充入4mol氮气和12mol氢气,使其在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g),2min末测得NH3为0.8mol,则:
2NH3(g),2min末测得NH3为0.8mol,则:
(1)以N2的浓度变化表示该反应在2min内的平均反应速率为;
(2)H2在2min末的体积分数为(保留两位有效数字);
(3)2min末N2的转化率为;
(4)已知在25℃,101kPa下,拆开1mol N2中的化学键需消耗946kJ的能量,拆开1mol H2中的H—H键要消耗436kJ的能量,而形成1mol N—H键会放出391kJ的能量。试通过以上数据计算当反应掉1molN2和3molH2生成2molNH3时会(填“放出”或“吸收”)热量;
(5)若将1mol N2和3molH2置于绝热密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25℃,101kPa)远小于上述计算值,你认为最可能的原因是。