中和相同体积、相同pH的H2SO4、HCl、CH3COOH三种溶液,所用相同浓度的NaOH的体积分别是V1、V2、V3,则三者的关系是:
| A.V1=V2=V3 | B.V1>V2>V3 | C.V3>V1>V2 | D.V1=V2<V3 |
下列涉及有机化合物的说法正确的是()
| A.除去乙烷中混有的乙烯,可将混合气体通过酸性高锰酸钾溶液 |
| B.丙烯分子中最多有6个原子共平面 |
| C.甲苯硝化制对硝基甲苯与苯甲酸和乙醇反应制苯甲酸乙酯的反应类型不同 |
| D.乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和碳酸钠溶液除去 |
把一小粒金属钠放入足量的硫酸铜溶液中。下列物质中属于该反应最终产物的是()
| A.Cu | B.NaOH | C.CuO | D.Cu(OH)2 |
丙烯醛的结构简式为: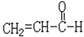 下列试剂中,不能跟丙烯醛反应的:()
下列试剂中,不能跟丙烯醛反应的:()
| A.溴水 | B.新制的Cu(OH)2 | C.Na2CO3溶液 | D.KMnO4酸性溶液 |
查阅资料发现,金属钠不仅能与氧气和水反应,还能与很多种其他物质发生反应,其中包括与酒精在常温下反应,要研究金属钠和酒精、金属钠和水反应的异同点,下列的研究方法中用不到的是()
| A.观察法 | B.分类法 | C.实验法 | D.比较法 |
下列叙述正确的是()
| A.元素的单质一定由氧化或还原该元素的化合物制得 |
| B.含有最高价元素的化合物不一定具有很强的氧化性 |
| C.阳离子只能得到电子被还原,阴离子只能失去电子被氧化 |
| D.在化学反应中,得电子越多的氧化剂,其氧化性就越强 |