下列说法正确的是( )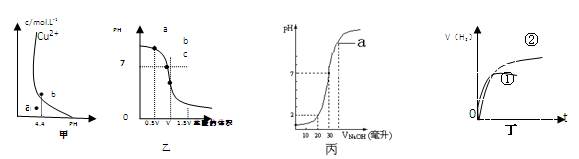
A.图甲表示某温度下,Cu(OH)2在溶液中达到沉淀溶解平衡后,改变溶液PH,Cu2+浓度的变化。由图可知 点溶液未达到饱和,因此, 点溶液未达到饱和,因此, 点的Ksp[Cu(OH)2]小于b点。 点的Ksp[Cu(OH)2]小于b点。 |
| B.图乙表示在室温时用一定浓度的盐酸滴定Vml同浓度的氨水。b点时溶液中C(NH4+)=C(Cl-),且溶液中水的电离程度最大。 |
| C.图丙表示在室温时,用0.1mol/LNaOH溶液滴定30.00ml0.15mol/LCH3COOH溶液,点a所示溶液中C(Na+)>C(CH3COO-)>C(OH-)>C(H+) |
| D.图丁可表示同体积同PH的某一元强酸溶液①和某一元中强酸溶液②分别 |
与足量的锌粉发生反应生成V(H2)随时间(t)的变化情况。
V mL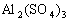 溶液中含
溶液中含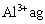 ,取
,取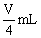 溶液稀释到4VmL,则稀释后溶液中
溶液稀释到4VmL,则稀释后溶液中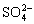 的物质的量浓度是()
的物质的量浓度是()
A. |
B.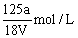 |
C.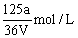 |
D.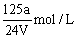 |
300mL某浓度的NaOH溶液中含有60g溶质。现要配制1mol/L NaOH溶液,应取原溶液与蒸馏水的体积比约为()
A 1:4 B 1:5 C 2:1 D 2:3
在标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为ρg·cm-3,则该盐酸的物质的量浓度是()
A.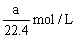 |
B.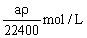 |
C.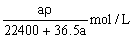 |
D.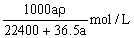 |
下列各图所示的实验原理、方法、装置和操作正确的是
| A.①干燥Cl2 | B.②检验K2CO3中的K+ |
| C.③石油的蒸馏 | D.④吸收NH3 |
不久前国内发生的“毒奶粉”事件中,不法分子向奶制品中加入了有毒的三聚氰胺物质,三聚氰胺结构简式如右下图所示,则下列关于三聚氰胺的说法不正确的是(已知氨分子为三角锥形分子)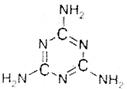
| A.含有不饱和碳原子,在一定条件下能发生加成反应 |
| B.三聚氰胺能接受质子,所以是一种质子碱 |
| C.分子中所有原子都在同一平面上 |
| D.在一定条件下能发生氧化反应 |