C3H8分子中共价键数为
| A.8 | B.10 | C.11 | D.12 |
将铁铝矾[Al2Fe(SO4)4·xH2O]溶于水中,得到浅绿色溶液,有关该溶液的叙述正确的是( )
| A.铁铝矾有净水作用,其水溶液显中性 |
B.该溶液中:2c(Al3+)+c(Fe2+)+c(H+)=4c(S )+c(OH-) )+c(OH-) |
| C.在空气中,该溶液蒸干并灼烧,最后所得的残留固体为Al2O3、Fe2O3 |
D.向该溶液中加入Ba(OH)2溶液,当S 完全沉淀时,Al3+、Fe2+恰好被完全沉淀 完全沉淀时,Al3+、Fe2+恰好被完全沉淀 |
下列说法正确的是( )
| A.100 ℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
| B.室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均 减小 |
| C.向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| D.向CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
| A.均存在电离平衡和水解平衡 |
| B.存在的粒子种类相同 |
| C.c(OH-)前者大于后者 |
D.分别加入NaOH固体,恢复到原温度,c(C )均增大 )均增大 |
下列说法正确的是( )
| A.AlCl3溶液和NaAlO2溶液分别加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 |
| B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 |
| C.用加热的方法可除去KNO3溶液中混有的Fe3+ |
| D.泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )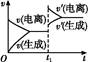
| A.加少量烧碱溶液 | B.升高温度 |
| C.加少量冰醋酸 | D.加水 |