下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是
| A.CaO + H2O = Ca(OH)2 | B.3NO2 + 2H2O = 2HNO3+NO |
C.2H2O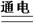 2H2↑+O2↑ 2H2↑+O2↑ |
D.2Na +2H2O =2NaOH+H2↑ |
下列有关同分异构体数目的叙述中,错误的是
| A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 |
| B.含有5个碳原子的饱和链烃,其一氯取代物共有8种 |
C.与 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 |
D.菲的结构简式为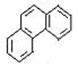 ,可有5种一硝基取代物 ,可有5种一硝基取代物 |
金银花中能提取出有很高药用价值的绿原酸(如下图),下列判断正确的是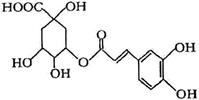
| A.分子中有可能所有碳原子共平面 | B.分子式为C16H18O9 |
| C.分子中含有醚键 | D.分子中有4个手性碳原子 |
下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是
| A.甲苯的硝化反应生成三硝基甲苯 | B.甲苯能使酸性高锰酸钾溶液褪色 |
| C.甲苯燃烧产生带浓烟的火焰 | D.1 mol甲苯与3 molH2发生加成反应 |
实验室可提供下列实验操作:①滴加AgNO3溶液;②加NaOH溶液;③加热;④加催化剂MnO2;⑤加蒸馏水过滤后取滤液;⑥过滤后取滤渣;⑦用HNO3酸化。如要鉴定1-氯丙烷中的氯元素,从中选择合适的操作步骤是
| A.③⑤⑦① | B.②③⑦① | C.②⑤⑦① | D.④②⑥① |
下列对有机物结构或性质的描述,错误的是
| A.1—溴丙烷与2—溴丙烷发生消去反应的产物不相同 |
| B.苯、甲苯在一定条件下均能发生取代反应 |
| C.通过红外光谱分析可以区分CH3CH2OH和CH3OCH3 |
D.异戊二烯( )与等物质的量的溴单质反应,产物只有一种 )与等物质的量的溴单质反应,产物只有一种 |