有H、D、T三种原子它们之间的关系是_____ ___。各1mol的H2、D2、T2三种单质中质子数之比是______ ___;在标准状况下,1L各种单质中它们的电子数之比是________,在标准状况下它们的单质的密度之比是____________。
今有相对分子质量为58的几种有机物,试写出符合条件的有机物的结构简式
(1)若该有机物为烃,则可能的结构简式为:、。
(2)若该有机物是一种饱和一元醛,则其结构简式为:。
(3)若该有机物1mol能与足量银氨溶液作用可析出4molAg,则有机物的结构简式为:。
(4)若该有机物能与金属钠反应,又能使溴的四氯化碳溶液褪色,则该有机可能是:
。(注羟基连在双键上的有机物极不稳定)
用系统命名法命名下列物质
27.书写下列物质的结构简式
(1)2-甲基-1-丁烯,
(2)支链上只有一个乙基,且式量最小的烷烃,
(3) 相对分子质量为72且沸点最低的烷烃的结构 简式。
简式。
(1)下列各组物质属于同系物的是__________,属于同分异构体的是____________,属于同素异形体的是____________,属于同位素的是____________,属于同一种物质的是____________。
①O2和O3 ②氕和氚 ③麦芽糖和蔗糖 ④苯和对二甲苯 ⑤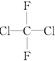 和
和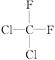
⑥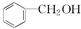 和
和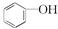 ⑦C2H2和C4H6 ⑧
⑦C2H2和C4H6 ⑧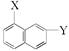 和
和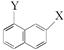 ⑨乙醇和甲醚 ⑩淀粉和纤维素 ⑪CH3CH2NO2和
⑨乙醇和甲醚 ⑩淀粉和纤维素 ⑪CH3CH2NO2和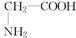
(2)、(3分)下列括号内的物质为杂质,将除去下列各组混合物中杂质所需的试剂填写在横线上:
乙烷(乙烯)苯(溴);乙炔(H2S)。
(3).若1 mol 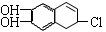 分别与浓溴水和NaOH溶液完全反应
分别与浓溴水和NaOH溶液完全反应 ,消耗Br2和NaOH的物质的量分别是mol和mol。
,消耗Br2和NaOH的物质的量分别是mol和mol。
某河道两旁有甲、乙两厂。它们 排放的工
排放的工 业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO
业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO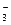 六种离子。
六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、________、_______。
(2)乙厂的废水中含有另外三种离子。如果加一定量________(选填“活性炭”“铁粉”),可以回收其中的________ (填写金属元素符号)。
(填写金属元素符号)。