NA表示阿伏加德罗常数,下列说法正确的是
A.1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子 Na与足量O2反应生成Na2O或Na2O2均失去NA个电子 |
|
B.1 mol Al分别放入足量的冷的浓HNO3稀 HNO3中,反应后转移的电子均为3NA个 HNO3中,反应后转移的电子均为3NA个 |
|
C.各5.6g铁分别与足量的盐酸.氯气反应,电子转移总数均为0.3NA |
D.2.7g铝与足量的NaOH溶液反应,转移的电子总数为NA |
一些烷烃的燃烧热如下表:
| 化合物 |
燃烧热/kJ/mol |
化合物 |
燃烧热/kJ/mol |
| 甲烷 |
891.0 |
正丁烷 |
2878.0 |
| 乙烷 |
1560.8 |
异丁烷 |
2869.6 |
| 丙烷 |
2221.5 |
异戊烷 |
3531.3 |
下列表达正确的是( )
A.正戊烷的燃烧热大于3531.3 kJ/mol
B.稳定性:正丁烷<异丁烷
C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)ΔH=-1560.8 kJ/mol
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+ O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ/mol 的说法中,正确的是( )
O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ/mol 的说法中,正确的是( )
| A.当转移10NA个电子时,该反应放出1300 kJ的能量 |
| B.当1NA个水分子生成且为液体时,吸收1300 kJ的能量 |
| C.当2NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
| D.当8NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
| A.-488.3 kJ/mol | B.+488.3 kJ/mol |
| C.-191 kJ/mol | D.+191 kJ/mol |
含1 mol Ba(OH)2的稀溶液与足量稀盐酸反应,放出热量114.6 kJ。下列热化学方程式中正确的是( )
| A.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l) ΔH=+114.6 kJ/mol |
| B.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l) ΔH=-114.6 kJ/mol |
C.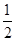 Ba(OH)2(aq)+HCl(aq)= Ba(OH)2(aq)+HCl(aq)=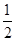 BaCl2(aq)+H2O(l) ΔH=-57.3 kJ/mol BaCl2(aq)+H2O(l) ΔH=-57.3 kJ/mol |
D.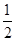 Ba(OH)2(aq)+HCl(aq)= Ba(OH)2(aq)+HCl(aq)=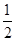 BaCl2(aq)+H2O(l) ΔH=+57.3 kJ/mol BaCl2(aq)+H2O(l) ΔH=+57.3 kJ/mol |
常温下,已知:
4Al(s)+3O2(g)=2Al2O3(s)ΔH1
4Fe(s)+3O2(g)=2Fe2O3(s)ΔH2
下面关于ΔH1、ΔH2的比较正确的是( )
| A.ΔH1>ΔH2 | B.ΔH1<ΔH2 |
| C.ΔH1=ΔH2 | D.无法计算 |