在体积为IL的密闭容器中,充入1mol CO2和3mol H2,—定条件下发生反应:
测得C02(g)和CH30H(g)的浓度随时间变化如图所示,则下列说法正确的是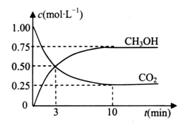
A. 反应进行到3分钟时达到平衡状态
B. 从反应开始到平衡,氢气的平均反应速率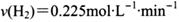
C. 反应达到平衡状态时,CO2的平衡转化率为25%
D . 若保持温度不变,
. 若保持温度不变, 向该容器中再充入1mol CO2和3molH2,平衡时
向该容器中再充入1mol CO2和3molH2,平衡时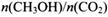 减小
减小
下列实验“操作和现象”与“结论”对应关系正确的是
| 操作和现象 |
结论 |
|
| A |
向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 |
HNO3分解生成了NO2 |
| B |
用铂丝蘸取溶液进行颜色反应,观察到火焰呈黄色。 |
该溶液一定是钠盐溶液 |
| C |
向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 |
析出了NaHCO3 |
| D |
常温下,将Al箔插入浓HNO3中,无明显现象。 |
铝和浓硝酸不反应 |
将一定量的醋酸与一定量的NaOH溶液混合,下列说法中不正确的是
| A.若混合后呈中性,则混合后的溶液中一定存在:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(OH-)=c(H+) |
| B.若混合后呈酸性,则混合后的溶液中可能存在:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C.若混合后呈碱性,则混合后的溶液中可能存在:c(Na+)>c(OH-)>c(CH3COO-)>c(CH3COOH)>c(H+) |
| D.若混合后的溶液中存在c(CH3COO-)+c(CH3COOH)=2c(Na+)等式,则也一定存在c(OH-)+c(CH3COO-)=c(CH3COOH)+c(H+)等式 |
下列说法中正确的是
| A.设NA为阿伏加德罗常数的值,1 mol羟基含有的电子数为10NA |
B.一定条件下,X、Y、Z、W之间有如下转化关系(忽略部分产物):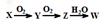 ,且已知常温下X与W能发生反应,则W可能为硝酸 ,且已知常温下X与W能发生反应,则W可能为硝酸 |
| C.水的离子积常数就是水的电离平衡常数 |
| D.盐酸滴入硫化钠溶液产生H2S气体,所以氯的非金属性强于硫 |
下列离子方程式正确的是
| A.0.01mol/L NH4Al(SO4)2溶液与0.01mol/L Ba(OH)2溶液等体积混合NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| B.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O |
| C.将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2= 2Fe3++4Br2+10Cl- |
| D.铁粉中滴加少量浓硝酸:Fe+3NO3-+6H+= Fe3++3NO2↑+3H2O |
人工光合作用能够借助太阳能,用CO2和水制备化学原料,如图是通过人工光合作用制备HCOOH原理示意图,下列说法中正确的是
| A.催化剂a处通CO2气体,催化剂b处加水 |
| B.催化剂a处发生的反应为2H2O+4e-= O2↑+4H+ |
| C.该电池的电解质溶液可采用HCOOH溶液 |
| D.在合成HCOOH的过程中,电池内部的H+的物质的量浓度不发生改变 |