下列化学实验事实及其解释都正确的是
| A.过量的铜屑与稀硝酸作用,反应停止后,再加入1mol/L稀硫酸,铜屑又逐渐溶解是因为铜可直接与1mol/L稀硫酸反应 |
| B.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜 |
| C.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
| D.工业制玻璃的主要反应之一:高温下Na2CO3+SiO2=Na2SiO3+CO2↑;该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释 |
物质X是某反应中的生成物,其质量变化为先增大,然后减小,下列各操作中指定物质数量变化符合此特征的是( )
| A |
B |
C |
D |
|
| 操作 |
向NaClO溶 液中通入SO2 |
向Na2CO3溶 液中滴加盐酸 |
向NaHCO3溶液 中滴加石灰水 |
向KBr溶液 中滴加稀氯水 |
| X |
Na2SO3 |
NaCl |
Na2CO3 |
Br2 |
某溶液中含有HCO 、CO
、CO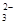 、SO
、SO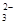 、Na+、NO
、Na+、NO 五种离子。若向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )
五种离子。若向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )
A.NO |
B.CO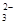 、NO 、NO |
C.SO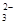 、NO 、NO |
D.CO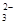 、NO 、NO 、Na+ 、Na+ |
下列各组中的实验步骤及现象,能达到相应实验目的的是
| 实验目的 |
实验步骤及现象 |
|
| A |
检验亚硫酸钠试样是否变质 |
试样  白色沉淀 白色沉淀 沉淀不溶解 沉淀不溶解 |
| B |
制取氯气并探究氯气是否具有漂白性 |
MnO2和稀盐酸 气体 气体 褪色 褪色 |
| C |
证明酸性条件H2O2氧化性比I2强 |
碘化钠溶液  溶液变蓝色 溶液变蓝色 |
| D |
探究浓度对于化学平衡的影响 |
FeCl3和KSCN混合溶液 红色变深 红色变深 |
某混合气体G可能含有CO、CO2、SO2、H2O等气体,用a.无水CuSO4、b.澄清石灰水、c.灼热CuO、d.碱石灰、e.品红溶液、f..酸性高锰酸钾溶液等药品可将其一一检出,检出的正确顺序是……()
| A.G→a→e→b→f→d→c | B.G→c→d→b→e→f→a |
| C.G→a→e→f→b→d→c | D.G→b→e→f→a→d→c |
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是()
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
陈述Ⅲ |
| A |
加压有利于提高SO2的转化率 |
工业生产硫酸常在高温下进行 |
Ⅰ对,Ⅱ对;有 |
| B |
Cl2和SO2混合后可用来漂白纸浆 |
Cl2和SO2都有较好的漂白作用 |
Ⅰ对,Ⅱ错;无 |
| C |
工业生产硫酸用水吸收SO3 |
SO3可与水反应 |
Ⅰ对,Ⅱ对;有 |
| D |
石墨常用作电解池的电极 |
石墨的化学性质稳定且导电性好 |
Ⅰ对,Ⅱ对;有 |