一些烷烃的燃烧热如下表:
| 化合物 |
燃烧热/kJ·mol-1 |
化合物 |
燃烧热/kJ·mol-1 |
| 甲烷 |
891.0 |
正丁烷 |
2878.0 |
| 乙烷 |
1560.8 |
异丁烷 |
2869.6 |
| 丙烷 |
2221.5 |
异戊烷 |
3531.3 |
下列表达正确的是
A.正戊烷的燃烧热小于3531.3kJ·mol- 1 1 |
| B.稳定性:正丁烷>异丁烷 |
| C.乙烷燃烧的热化学方程式为: 2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ;△H= -1560.8 kJ |
| D.相同物质的量的烷烃CnH2n+2,n越大,燃烧放出的热量越多 |
下列物质可以使蛋白质变性的是
①福尔马林②酒精③高锰酸钾溶液④硫酸铵⑤硫酸铜⑥双氧水⑦硝酸
A除④⑦外 B除③⑥外 C①②⑤ D除④外
下列各组物质中,一定属于同系物的是
| A.甲酸、硬脂酸 | B.CH4O、C2H6O |
C.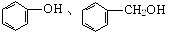 |
D.CH3OH、CH2(OH)CH2OH |
下列各化合物的命名中正确的是
| A.CH2=CH-CH=CH2 1,3—二丁烯 | B.CH3 –O –CH3乙醚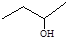  |
| C.3―丁醇 | D.2―甲基丁烷 |
下列分子式只能表示一种物质的是
| A.C3H7Cl | B.CH2Cl2 | C.C7H8O | D.C2H4O2 |
利用核聚变发电,3He是最安全、最清洁的能源。地球上3He仅有15吨左右,月球上的3He最保守估计可供全世界开采500年。地球上的氦元素主要以4He形式存在,而月球土壤中吸附着数百万吨3He。下列说法正确的是
①3He、4He的化学性质基本相同;②3He、4He具有相同的中子数;③3He核聚变是化学变化;④3He液化是物理变化;⑤3He和4He形成的晶体类型相同,所含化学键不同;⑥3He和4He组成的气体单质,在 相同条件下密度之比为3︰4。
相同条件下密度之比为3︰4。
| A.①②⑤ | B.①④⑥ | C.②③⑤ | D.③④⑥ |