(15分)铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知
Cu(s) + 2H+(aq) ="=" Cu2+(aq) + H2(g) △H= +64.39kJ/mol
2H2O2(l) ="=" 2H2O(l) + O2 (g) △H= ﹣196.46kJ/mol
H2(g) +1/2 O2 (g)="=" H2O(l) △H= ﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为
(2)镁铝合金生活中应用广泛。取样品a克,溶于200ml 5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围 ,向反应后溶液中加入4mol/L NaOH溶液 ml,沉淀质量达到最 大
大 值。
值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67 .2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为 ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量 g。(用含a的代数式表示)
.2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为 ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量 g。(用含a的代数式表示)
原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的2倍;b和d的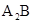 型氢化物均为
型氢化物均为 型分子,c的
型分子,c的 价离子比e的
价离子比e的 价离子少8个电子。回答下列问题;
价离子少8个电子。回答下列问题;
(1)元素a为,c为。
(2)这些元素的单质或由它们形成的 型化合物中,其晶体类型属于原子晶体的是,离子晶体的是,金属晶体的是,分子晶体的是(每空填一种)。
型化合物中,其晶体类型属于原子晶体的是,离子晶体的是,金属晶体的是,分子晶体的是(每空填一种)。
(3)(每空2分)由这些元素形成的三原子分子中,分子的空间结构属于直线的是,非直线的是(各写2种)。
(每空1分,共8分)下列微粒:① ;②
;②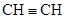 ;③
;③ ;④
;④ ;⑤
;⑤ 填写下列空白(填序号)
填写下列空白(填序号)
(1)呈正四面体的是。
(2)中心原子轨道采取 杂化的化合物是,采取
杂化的化合物是,采取 杂化的化合物是,采取
杂化的化合物是,采取 杂化的化合物是。
杂化的化合物是。
(3)所有原子共平面的是,共线的是。
(4)微粒存在的配位键的是。
(5)含有极性键的极性分子是。
某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl-、CO32-、
SO42-,现每次取该溶液100.00ml溶液进行以下实验:
①第一份加入AgNO3溶液发现有沉淀生成;
②第二份加足量BaCl2溶液生成沉淀,洗涤后干燥得沉淀6.27g,再将该沉淀加入足量盐酸溶解后再过滤洗
涤干燥得沉淀2.33g.
请回答下列问题:
(1)根据以上实验判断,原溶液中一定不存在的离子是,可能存在的离子是。
(2)原溶液中一定存在的阳离子是,其物质的量浓度至少为mol/l.
(3)原溶液中一定存在的阴离子是,其物质的量浓度分别为mol/L、mol/l.。
实验室需要 0.1mol/L的 H2SO4溶液980mL,欲用 98%、密度为1.84g/cm3的浓硫酸配制.
(1)所需的主要仪器除量筒、烧杯、玻璃棒外,还需要、。
(2)其实验操作步骤可分为以下几步:
A.用量筒量取mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①完成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):
( D )→( A )→( C )→()→()→()→( F )。
③将浓硫酸在烧杯中稀释后移入容量瓶时,必须_________________方可移液.
(3)试分析下列操作对所配溶液的浓度有何影响
①量取浓硫酸时眼睛俯视量筒刻度线,会导致所配溶液浓度会;(填: 偏高、偏低、或无影响,下同)
②定容时,眼睛仰视刻度线,所配溶液浓度会;
(1)写出下列化学反应的离子方程式
①氢氧化钡溶液和硫酸溶液反应
②碳酸钙和足量稀盐酸反应
(2)根据下列离子方程式,各写一个符合条件的化学方程式
①Zn+2H+==Zn2++H2↑
②HCO3-+ H+==CO2↑+ H2O