下图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是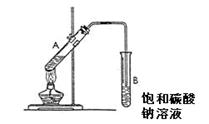
| A.向A试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 |
| B.试管B中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象 |
C.实验时加热试管A的目的之一是及时将乙酸乙酯蒸 出,使平衡向生成乙酸乙酯的方向移动 出,使平衡向生成乙酸乙酯的方向移动 |
| D.试管B中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 |
3.下列有关化学用语表示正确的是
A.氮气的电子式: |
B.羟基的电子式: |
C.氯离子的结构示意图: |
D.质子数为92、中子数为146的铀(U)原子的核素符号: |
2.下列有关物质水解的说法正确的是
| A.纤维素不能水解成葡萄糖 | B.油脂水解产物之一是甘油 |
| C.蛋白质水解的最终产物是多肽 | D.蔗糖水解产物仅有葡萄糖 |
1.下列叙述中不正确的是
| A.SO2是大气污染物之一 |
| B.食物腐败变质发生了化学变化 |
| C.凡含有添加剂的食物对人体健康均有害,不宜食用 |
| D.废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源 |
16.工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是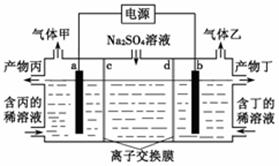
| A.a极与电源的负极相连 |
| B.产物丙为硫酸溶液 |
| C.离子交换膜d为阴离子交换膜 |
| D.a电极反应式:2H2O+2e-= H2↑+2OH- |
15.反应A(g)+3B(g) 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(C)="0.4" mol / (L·s)B.υ(B)="0.45" mol / (L·s)
C.υ(A)="0.15" mol / (L·s)D.υ(D)="0.35" mol / (L·s)