有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为: 。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为: 。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标况)。 |
(3)用结构简式表示A中含有的官能团: 。 |
(4)A的核磁共振氢谱如下图: |
(4)A中含有 种氢原子。 |
| (5)综上所述,A的结构简式 。 |
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。请回答下列问题:
(1)上述元素的最高价氧化物对应的水化物酸性最强的是_______(写化学式),非金属气态氢化物还原性最强的是____________(写化学式)。
(2)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______(写出其中两种物质的化学式)。
(3)X2M的燃烧热ΔH= -a kJ·mol-1,写出X2M燃烧反应的热化学方程式:______。
(4)ZX的电子式为________;ZX与水反应放出气体的化学方程式为___。
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用反应:6NO2 + 8NH3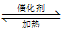 7N2 + 12 H2O处理NO2。120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2) =______。
7N2 + 12 H2O处理NO2。120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2) =______。
(2)一定条件下SO2与NO2可发生反应,方程式:NO2(g)+SO2(g)  SO3(g)+NO(g) △H>0 将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是 __。
SO3(g)+NO(g) △H>0 将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是 __。
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO2和SO3的体积比保持不变
d.混合气体的平均相对分子质量保持不变
(3)如果上述反应的平衡常数K值变大,该反应___________(填序号)。
a.一定向正反应方向移动
b.平衡移动时,正反应速率先减小后增大
c.一定向逆反应方向移动
d.平衡移动时,逆反应速率先增大后减小
如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视,所以“低碳经济”正成为科学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。
进行反应 得到如下两组数据:
得到如下两组数据: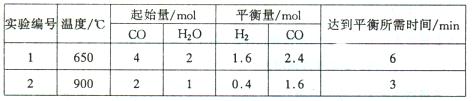
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为。(精确到0.01,下同)
②该反应为(填“吸”或“放”)热反应,实验2条件下平衡常数K= 。
(2)以二甲醚(CH3OCH3)、空气、氢氧化钾为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式:。
(3)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为- 285.8 kJ·mol-1、- 283.0 kJ·mol -1和- 726.5 kJ·mol-1。请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:。
已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1, c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为。
(2)若反应温度升高,M的转化率(填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)="2" mol·L-1,a=。
(4)若反应温度不变,反应物的起始浓度为:c(M)="c(N)=" bmol·L-1,达到平衡后,M的转化率为。
I.Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2。
 (1)电池正极发生的电极反应为;
(1)电池正极发生的电极反应为; (2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是,反应的化学方程式为;
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是,反应的化学方程式为;
II.熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。
(3)该燃料电池负极电极反应式为;
(4)该燃料电池正极电极反应式为。