某原电池总反应的离子方程式为2Fe3++Fe==3Fe2+,不能实现该反应的原电池是
| A.正极为铜,负极为铁,电解质溶液为 FeCl3溶液 | |
| B.正极为C,负极为Fe,电解质溶液为 Fe(NO3)3 |
C.负极为锌,正极为铁,电解质溶液为 Fe2(SO4)3 |
| D.负极为铁,正极为铁,电解质溶液为 CuSO4 |
在容积可变的密闭容器中存在如下反应:2A(g)+B(g) 3C(g) ΔH<0,某研究小组研究了其他条件不变时,只改变某一条件对上述反应的影响,下列分析正确的是( )
3C(g) ΔH<0,某研究小组研究了其他条件不变时,只改变某一条件对上述反应的影响,下列分析正确的是( )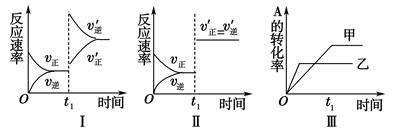
| A.图Ⅰ表示的是t1时刻升高温度对反应速率的影响 |
| B.图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高 |
| D.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 |
一定条件下,对于可逆反应X(g)+3Y(g)  2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.12 mol/L,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.12 mol/L,则下列判断正确的是( )
| A.c1 : c2=1 : 3 |
| B.平衡时,3VY (正) =2VZ (逆) |
| C.X、Y的转化率相等 |
| D.c1的取值范围为0.06<c1<0.16 mol/L |
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g)△H=Q kJ·mol-1;反应达到平衡时,X的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g)△H=Q kJ·mol-1;反应达到平衡时,X的物质的量浓度与温度、气体体积的关系如下表所示:
| 容器体积/L c(X)/mol·L—1 温度/℃ |
1 |
2 |
3 |
| 100 |
1.00 |
0.75 |
0.53 |
| 200 |
1.20 |
0. 90 |
0.63 |
| 300 |
1.30 |
1.00 |
0.70 |
下列说法正确的是( )
A.m>n
B.温度不变,增大体积,X的转化率增大
C.Q<0
D.体积不变,温度升高,平衡向正反应方向移动
某二元酸(H2A)在水中的电离式为:H2A=H+ + HA-,HA- H+ + A2-,则下列说法正确的是( )
H+ + A2-,则下列说法正确的是( )
A.0.1mol/L Na2A溶液中存在的粒子浓度关系:c(A2-) + c(HA-) + c(H2A) = 0.1mol/L
B.0.1mol/L的NaHA溶液中离子浓度为:c(Na+)>c(HA-) >c(A2-) >c(H+)>c(OH-)
C.若0.1mol/L的NaHA溶液pH=2.0,则0.1mol/L的H2A溶液中,c(H+)<0.11mol/L
D.等物质的量浓度、等体积的H2A和NaOH溶液混合反应后,溶液可能呈中性或碱性
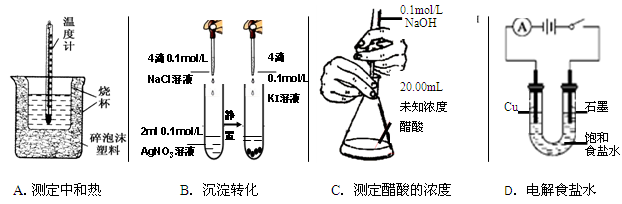
下列实验装置、操作能达到实验目的的是( )