如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略。将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间。 
(1)经过几个小时的反应后,U型管左端产生的现象是: __ _____,____ ______,_ __
右端的玻璃管中水柱变化是 。
A.升高 B.降低 C.不变 D.无法确定
(2)试解释U型管右端的玻璃管中水柱变化的原因
(3)在反应生成物中:常用作有机溶剂的是_______,常用作灭火剂的是__ ,
呈气态的有 ___ __ (每空填一种)
(4)写出符合下列条件的甲烷的一种同系物的结构简式
A.氢原子数为十二 ,B.一氯取代物只有一种结构
按要求对下图中两极进行必要的连接并填空:
(1)在A图中,使铜片上冒H2气泡。请加以必要连接,
则连接后的装置叫。
电极反应式:锌板: _______________;
铜板: ___________
(2)在B图中,(a和b均为惰性电极)
使a极析出铜,请加以必要的连接后,该装置叫。
电极反应式,a极:;b极: 。
在经过一段时间后,停止反应并搅均溶液,溶液的pH(升高、降低、不变),加入一定量的 后,溶液能恢复至与电解前完全一致。
已知pH为4-5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,过程如下: 回答下列问题:
回答下列问题:
(1)加入CuO的作用是。
(2)步骤②中所用的部分仪器如右下图所示,则A、B分别连直流电源的和极(填“正”或“负”)。
(3)电解开始后,在U形管中可以观察到的现象有:电解的离子方程式(总反应)为。
(4)下列实验操作中必要的是(填写字母)。
(A)称量电解前的电极的质量;
(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;
(C)刮下电解后电极上析出的铜,并清洗,称量;
(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→
再称量”进行;
(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为(用带有m、V的计
算式表示)。
现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
图1酸度对铟浸出率的影响图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:
①从保护环境和充分利用原料角度,如何处理或利用烟气。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式____________________、_______________。
某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuCl2?2H2O晶体。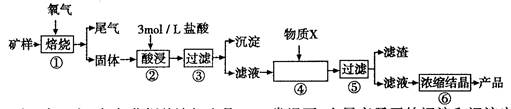
已知:在20℃时,氯化铜的溶解度是73g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
| 金属离子 |
开始形成氢氧化物沉淀的pH |
完全形成氢氧化物沉淀的pH |
| Fe2+ |
7.0 |
9.0 |
| Fe3+ |
1.9 |
3.2 |
| Cu2+ |
4.7 |
6.7 |
回答下列问题:
(1)步骤①的焙烧过程中需要通入氧气。在实验室中使用中学化学常见物质、下图所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式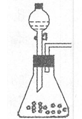
(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物。
若在实验室中以碱液吸收处理之,下列A、B、C装置中可行的是____(填字母);若选用甲装置,则烧杯中的下层液体可以是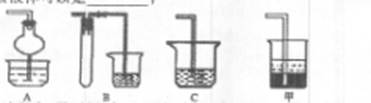
(3)步骤②酸浸过程中,需要用到3 mollL的盐酸l00mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有____;
(4)步骤④加入物质X的目的是,物质X可以选用下列物质中的;
A.氧化铜 B.稀盐酸 C.氨水 D.氧化亚铁
(5)在整个生产流程中,共需要进行次过滤操作。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则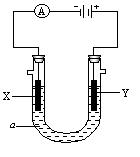
①电解池中X极上的电极反应式是。
在X极附近观察到的现象是。
②Y电极上的电极反应式是,
检验该电极反应产物的方法是。
⑵如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是,电极反应式是
②Y电极的材料是,电极反应式是
(说明:杂质发生的电极反应不必写出)