某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A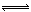 H++HA- HA-
H++HA- HA-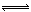 H++A2-;设有下列四种溶液:
H++A2-;设有下列四种溶液:
(1)0.01mol.L-1的H2A溶液
(2)0.01mol.L-1的NaHA溶液
(3)0.02mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
(4)0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合液
下列说法正确的是
A C(H+)最大的是(2) B C (A2-) 最小的是(2)
C C( H2A)最大的是(3) D C(HA-)最大的是(1)
将a moL/L的Na2CO3溶液与b mol/L的NaHCO3溶液等体积混 合,所得溶液中粒子浓度间的关系及相关判断不正确的是()
合,所得溶液中粒子浓度间的关系及相关判断不正确的是()
| A.c(Na+)+c(H+)>c(CO32-)+c(HCO3-)+c(OH-) |
| B.c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3) |
| C.若c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),则一定a<b |
D.若c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H 2CO3),则可确定a=b 2CO3),则可确定a=b |
下列叙述正确的是( )
| A.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]<c(NH4Cl) |
| B.向AgCl悬浊液中滴入KI溶液,有AgI沉淀生成,说明AgCl的溶解度小于AgI的溶解度 |
| C.0.2 mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=2c(CO32-)+c(OH-) |
| D.等体积、等物质的量浓度的Ba(OH)2、KOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,若混合后溶液均呈中性,则V1>V2>V3 |
1909年丹麦科学家Sorensen用公式pH=-lgc(H+)引入pH,1999年荷兰科学家HenK Van Lubeck提出酸度(AG)的概念,以更好地表示溶液的酸碱性。酸度(AG)的定义为 。 下列有关叙述中错误的是( )
。 下列有关叙述中错误的是( )
| A.常温时,中性溶液的pH=7,AG=0 |
B.酸性溶液 的AG>0,AG越大,溶液的pH越小 的AG>0,AG越大,溶液的pH越小 |
| C.碱性溶液的AG>0,AG越大,溶液的pH越大 |
| D.常温下,0.1 mol/LNaOH溶液,AG=-12,pH=13 |
两根金属铂做电极,以KOH溶液做电解质溶液,从两极分别通入CH4(g)和O2,则对该燃料电池的下列叙述中正确的是()
A.负极的电极反应式为:CH4-8e-+10OH-=CO32 -+7H2O -+7H2O |
| B.负极的电极反应式为:4OH--4e-=2H2O+O2↑ |
C.标准状况下,通入5.6 LO2并完 全反应后,有0.50mol电子转移 全反应后,有0.50mol电子转移 |
| D.放电一段时间后,通入O2的电极附近溶液的pH降低 |
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀硫酸溶液中,A为负极;②C、D用导线相连后,同时浸入稀硫酸溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀硫酸溶液中,C极产生大量气泡;④B、D用导线相连后 ,同时浸入稀硫酸溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是( )
,同时浸入稀硫酸溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是( )
A.A>B>C>DB.A>C>D>B C.C>A>B>D D.B>D>C>A