用下图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验
不合理的是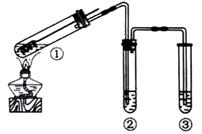
| A.③中选用NaOH溶液吸收多余的SO2 |
| B.上下移动①中铜丝可控制SO2的量 |
| C.②中选用品红溶液验证SO2的生成 |
| D.为确认CuSO4生成,向①中加水,观察颜色 |
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+ H+,对于该平衡,下列叙述正确的是( )
CH3COO-+ H+,对于该平衡,下列叙述正确的是( )
| A.降温可以促进醋酸电离,会使氢离子浓度增大 |
| B.加入少量0.1 mol·L-1HCl溶液,溶液中c(H+)不变 |
| C.加入少量NaOH固体,平衡向正反应方向移动 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
一定温度下,向容积固定不变的容器中充入a mol NO2,发生如下反应:
2NO2(g) N2O4(g),达到平衡后,再向该容器中充入amol NO2,达到平衡后与原来平衡比较正确的是( )
N2O4(g),达到平衡后,再向该容器中充入amol NO2,达到平衡后与原来平衡比较正确的是( )
| A.NO2的转化率提高 | B.颜色变浅 |
| C.压强为原来的两倍 | D.平均相对分子质量减小 |
常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于( )
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
若NA表示阿伏加德罗常数,下列说法正确的是( )
| A.pH=1的硫酸溶液所含的H+数为NA个 |
| B.20 g重水(D2O)中含有的电子数为10NA个 |
| C.粗铜电解精炼时,阳极减少6.4 g,则转移电子数一定是0.2 NA个 |
| D.在密闭容器中加入1molN2和3molH2充分反应可得到NH3分子数为2NA个 |
高炉炼铁的主要反应是:Fe2O3+3CO 2Fe +3CO2。下列说法正确的是()
2Fe +3CO2。下列说法正确的是()
A.CO2的电子式为 |
| B.Fe2O3分别与浓硝酸和稀硝酸反应,二者产物不同 |
| C.在高炉炼铁过程中,若增加炼铁高炉的高度能提高CO的转化率 |
| D.在高炉炼铁过程中,将铁矿石粉碎后投入高炉可以提高该反应的化学反应速率 |