下列排列顺序不正确的是
A、微粒半径:Na+ > K+ > Cl- > S2- B、酸性:HClO4 > H2SO4 > H3PO4 > H2SiO
> H2SO4 > H3PO4 > H2SiO
C 、稳定性:HI > HBr > HCl > HF 3 D、碱性:KOH > Ca(OH)2 > Mg(OH)2 > Al(OH)3
、稳定性:HI > HBr > HCl > HF 3 D、碱性:KOH > Ca(OH)2 > Mg(OH)2 > Al(OH)3
在一定温度下A(气)+3B(气)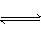 2C(气)达平衡的标志是( )
2C(气)达平衡的标志是( )
A.物质A、B、C的分子个数比为1:3:2
B.单位时间内生成A、C的物质的量之比为1:2
C.单位时间内生成A、B的物质的量之比为1:3
D.反应速率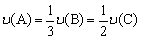
在容积固定的密闭容器中存在如下反应:A(g)+3B(g)  2C(g);△H<0
2C(g);△H<0
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断一定错误的是()
| A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
| B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高 |
| C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高 |
| D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是()
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是()
| A.3v正(N2)=v正(H2) | B.v正(N2)=v逆(NH3) |
| C.2v正(H2)=3v逆(NH3) | D.v正(N2)=3v逆(H2) |
某温度下,在一容积可变的容器中,反应2A(g)+B(g) 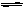 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是()
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是()
(A)均减半(B)均加倍(C)均增加1mol (D)均减小1mol
一定条件下,在密闭容器里进行如下可逆反应: S2Cl2(橙黄色液体)+Cl2(气) 2SCl2(鲜红色液体)+61.16kJ。下列说法正确的是()
2SCl2(鲜红色液体)+61.16kJ。下列说法正确的是()
| A.单位时间里生成n mol S2Cl2的同时也生成n molCl2 |
| B.达到平衡时,若升高温度,压强不变,反应混合溶液颜色变浅 |
| C.达到平衡时,单位时间里消耗n mol S2Cl2的同时也生成n molCl2 |
| D.加入氯气,平衡向正反应方向移动,氯气的转化率一定升高 |