在分析某些溶液中的离子成分时,为了排除其他
离子可能的干扰,通常先在溶液中加入一些试剂对干扰离子进行掩蔽以得到准确的结果。下列掩蔽方法和分析结果正确的是 ( )
| A.某溶液中滴加氯水后再滴加KSCN溶液出现血红色,该溶液中含有Fe3+ |
| B.某溶液中滴加NaOH溶液后再滴加CaCl2溶液出现白色沉淀,该溶液中含有CO2-3 |
| C.某溶液中滴加氨水后再滴加NaOH溶液出现白色沉淀,该溶液中含有Al3+ |
| D.某溶液中滴加足量稀盐酸后,再滴加BaCl2溶液才出现白色沉淀,该溶液中含有SO2-4 |
世界著名的科技史专家、英国剑桥大学的李约瑟博士说:“中国至少在距今3 000年以前,就已经使用玻璃了。”下列有关玻璃的说法不正确的是
| A.制普通玻璃的原料主要是纯碱、石灰石和石英 |
| B.玻璃在加热熔化时有固定的熔点 |
| C.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅 |
| D.盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅生成硅酸钠而使瓶塞与瓶口黏在一起 |
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不会发生的化学反应是
| A.4Fe(OH)2+2H2O+O2====4Fe(OH)3↓ |
| B.2Fe+2H2O+O2====2Fe(OH)2↓ |
| C.2H2O+O2+4e-====4OH- |
| D.Fe-3e-====Fe3+ |
北京2008奥运会金牌直径为70 mm,厚6 mm。某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金)制成。为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误,可选用
| A.硫酸铜溶液 | B.盐酸 | C.稀硝酸 | D.硝酸银溶液 |
如右图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动)。下列叙述正确的是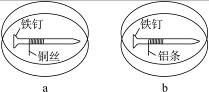
| A.a中铁钉附近呈现红色 |
| B.b中铁钉上发生还原反应 |
| C.a中铜丝上发生氧化反应 |
| D.b中铝条附近有气泡产生 |
将金属A和金属B分别放入稀硫酸中有氢气生成。若将金属A和金属B相连后投入稀硫酸中发现A被腐蚀,B未被腐蚀。关于A、B的叙述正确的是
A.金属活动性A>B
B.还原性 B>A
C.在后者装置中金属A发生还原反应,金属B发生氧化反应
D.金属A表面有明显气泡产生,金属B表面无明显现象