缓冲溶液可以抗御少量酸碱对溶液pH的影响。人体血液量最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3-),维持血液的pH稳定。已知在人体正常体温时,反应H2CO3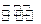 HCO3-+H+的Ka=10-6.1,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,1g2=0.3。则下列判断正确的是( )
HCO3-+H+的Ka=10-6.1,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,1g2=0.3。则下列判断正确的是( )
| A.正常人血液内Kw=10-14 |
B.由题给数据可算得正常人血液的pH约为7.4 |
| C.正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) | |
| D.当过量的碱进入血液中时,只有发生HCO3-+OH=CO32-+H2O的反应 |
工业炼铁,用到的原料有:铁矿石、焦炭、空气、石灰石,下列对原料在冶炼过程中的作用叙述不正确的是:
| A.焦炭是铁矿石炼铁时的还原剂 | B.空气在与焦炭的反应中,为炼铁提供能量 |
| C.石灰石是助矿石中杂质形成炉渣 | D.固体原料需粉碎,增大与气体的接触面 |
已知KMnO4与浓HCl在常温下反应就能产生Cl2。 若用右图所示装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元,其中错误的是: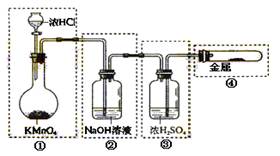
| A.只有①和②处 | B.只有②处 |
| C.只有②和③处 | D.只有②、③、④处 |
有人设想将不溶的碳酸盐材料通过特殊的加工方法使之变为纳米碳酸盐材料(即碳酸盐材
料粒子直径是纳米级),这将使建筑材料的性能发生巨大变化,下列关于纳米碳酸盐材料
的推测正确的是:
| A.纳米碳酸盐材料是与胶体相似的分散系 |
| B.纳米碳酸盐材料分散到水中会产生丁达尔效应 |
| C.纳米碳酸盐材料的化学性质已与原来的碳酸盐材料完全不同 |
| D.纳米碳酸盐材料的粒子不能透过滤纸 |
如图所示,2个X分子反应生成1个Y分子和3个Z分子,下列判断不正确的是: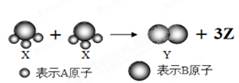
| A.根据质量守恒定律可推知,1个Z分子中含有2个同种元素的原子 |
| B.该反应属于分解反应 |
| C.该反应属于氧化还原反应 |
| D.X、Y、Z三种物质均属于非电解质 |
下列叙述正确的是:
| A.液氯无酸性、氯水有酸性 | B.海水提镁的主要步骤为:(下图) |
| C.硅酸钠固体俗称水玻璃 | D.Na2O2能与水反应,可以做干燥剂 |