某元素原子的最外层电子数是次外层的a倍(a>1),则该原子的核内质子数是
| A.2a+2 | B.2a+10 | C.a+2 | D.2a |
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是()
| A.p(Ne)>p(H2)>p(O2) | B.p(O2)>p(Ne)>p(H2) |
| C.p(H2)>p(O2)>p(Ne) | D.p(H2)>p(Ne)>p(O2) |
下列有关钠的叙述中错误的是()
| A.电解法冶炼金属钠时,钠在阳极析出 |
| B.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 |
| C.钠的还原性很强,可以用来冶炼金属钛、锆、铌等 |
| D.钠的质地软,可用小刀切割 |
下列叙述正确的是()
| A.P4和NO2都是共价化合物 |
| B.CCl4和NH3都是以极性键结合的极性分子 |
| C.在CaO和SiO2晶体中都不存在单个小分子 |
| D.甲烷是对称平面结构,是非极性分子 |
向盛有Cl2的三个集气瓶甲、乙、丙中各加入下列液体中的一种,经振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是()
①AgNO3溶液②NaOH溶液③水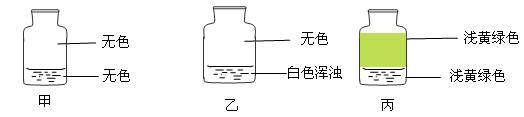
| A.①②③ | B.②①③ | C.③②① | D.①③② |
在0.1 mol·L-1Na2CO3溶液中,下列关系正确的是()
| A.c(Na+)>c(CO32一)>c(OH一)>c(HCO3一)>c(H+) |
| B.c(Na+)+c(H+)=c(HCO3一)+c(CO32-)+c(OH一) |
| C.c(Na+)>c(CO32一)>c(HCO3-)>c(H+)>c(OH一) |
| D.c(HCO3一)+2c(CO32一)+c(H2CO3)="0.1" mol·L-1 |