以NA代表阿伏加德罗常数,则关于热化学方程式
C2H2(g)+ 5/2 O2(g)=2CO2(g)+H2O(l) △H =—1300kJ/mol的说法中,正确的是
| A.有10NA个电子转移时,该反应放出1300kJ的能量 |
| B.有NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C.有4NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D.有8NA个碳氧双键生成时,放出1300kJ的能量 |
2003年诺贝尔化学奖授予美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成果。Mackinnon教授的研究内容主要是Na 、K
、K 虽然体积很接近,但在生物体内呈现的差别却高达1万倍,他让科学家们观测到Na
虽然体积很接近,但在生物体内呈现的差别却高达1万倍,他让科学家们观测到Na 、K
、K 在进入离子通道前、通道中以及穿过通道后的状态,在医学应用上可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是()
在进入离子通道前、通道中以及穿过通道后的状态,在医学应用上可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是()
| A.质钠的密度比钾的密度小 |
| B.和钾在空气中燃烧的产物都是过氧化物 |
| C.一小块钠投入盛5 mL澄清石灰水的试管里,可能观察到溶液变浑浊 |
| D.和钾的合金〔w(K)=50%~80%〕熔点比钠和钾都高 |
将一小块钠投入FeCl 溶液中,下列对有关实验结果的预测正确的是()
溶液中,下列对有关实验结果的预测正确的是()
| A.钠溶解,有铁析出,并有气体产生 |
| B.只有气体产生 |
| C.只有沉淀产生 |
| D.既有沉淀产生,又有气体产生 |
可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法是()
| A.加热时有无色气体放出 |
| B.滴加盐酸时有气泡放出 |
| C.溶于水后滴加澄清石灰水,有白色沉淀生成 |
D.溶于水后滴加BaCl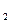 稀溶液,有白色沉淀生成 稀溶液,有白色沉淀生成 |
下列物质既能与盐酸作用,又能与澄清石灰水作用的是()
| A.NaOH | B.NaNO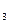 |
C.Na SO 4 SO 4 |
D.NaHCO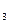 |
向0.1 mol·L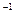 NaOH溶液中通入过量CO
NaOH溶液中通入过量CO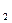 后,溶液中存在的主要离子是()
后,溶液中存在的主要离子是()
A.Na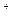 、CO 、CO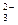 |
B.Na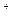 、HCO 、HCO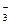 |
C.HCO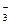 、CO 、CO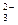 |
D.Na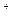 、OH 、OH |