(15分)
已知G是合成某高分子化合物的原料,只含C、H、O三种元素,5.9g物质G能与1mol/LNaOH的溶液100mL恰好完全反应,0.1mol物质G与足量金属钠反应在标准状况下生成2.24L氢气,分子结构中含有一个甲基,A的分子式为C8H13O2Br,有机物A、B、C、D、E、F、G之间的相互转化关系如图所示: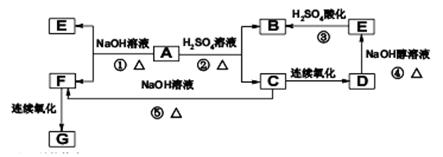
⑴写出C的结构简式: .
⑵A中官能团名称是: .
⑶B的同分异构体中属于酯的有多种,任写其中三种属于酯类的结构简式:
, , .
⑷写出D→E化学反应方程式: .
⑸写出反应①化学反应方程式:
⑹写出由F和G 在一定条件下合成高分子化合物的化学反应方程式:
.
(1)配平该反应并标出电子转移的方向和数目:KMnO4+HCl = MnCl2+ KCl+ Cl2↑+ H2O
(2)氧化剂是________________,氧化产物是__________________(填化学式)。
(3)若生成71 g Cl2消耗的HCl是___________________,被氧化的HCl是_______________。
(4)CS2(液体)能在O2中完全燃烧,生成CO2和SO2,若将0.1 mol CS2在1 mol O2中完全燃烧,所得混合气体在标准状况下所占的体积为__________L。
Ⅱ、(6分)(1)下列A. B. C. D 是中学常见的混合物分离或提纯的基本装置
请根据实验需要将A. B.C. D装置填入适当的空格中。
①分离汽油和氯化钠溶液____________________
②用自来水制取蒸馏水__________________
③除去粗盐溶液中悬浮的泥沙_______________________________
(2)检验Fe3+常用的试剂除碱外,还可以将KSCN溶液滴入待检测溶液中,其产生的现象是______
________________________,发生反应的离子方程式________________________________。
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O,工艺流程如下(部分操作和条件略):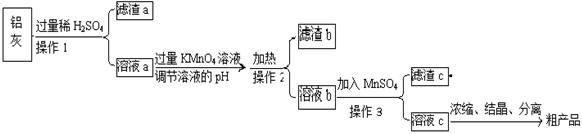
(1)滤渣a可用于制造
(2)请将MnO4-氧化Fe2+的离子方程式补充完整:
若反应中转移了2mol电子,则消耗氧化剂的物质的量为 mol。
(3)已知生成氢氧化物沉淀的pH如下:
| Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
调节溶液pH约为3的目的是: 。
(4)取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体,说明滤渣C的主要成分是 。请写出加入MnSO4时所发生反应的离子方程式: 。
(5)A12(SO4)3·18H2O溶于水溶液呈酸性的原因: 。(用离子方程式表示)
置换反应可用下图表示,回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为。
(2)若过量单质甲与化合物A发生反应现象为溶液由蓝色变为浅绿色, 除去反应后混合物中剩余的甲所用的试剂名称是写出单质甲与化合物A反就的离子方程式。
(3)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式
(4)若单质乙是红色金属固体单质,化合物B常温下为无色液体,则该反应的化学方程式为。
A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,K、L是无色气体,且K是非极性分子,F、H是黑色晶体。以上物质相互间的转化关系如下图所示:
请回答下列问题:
(1)元素A的核外电子排布式为________________。
(2)D能与氢氧化钠溶液反应,请写出该反应的离子方程式___________________。
(3)写出A与G反应的化学方程式_______________________________________。
(4)写出H和D反应的化学方程式______________________________________。
(5)写出K与E反应的化学方程式_________________________________________。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)④、⑤、⑥的原子半径由大到小的顺序为________________。(用元素符号表示)
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是________。(用化学式表示)
(3)某化合物由①、④、⑧三种元素组成,它有强氧化性,是很好的漂白剂、杀菌剂,请写出它的化学式:____________________。
(4)Ⅰ.下列可作为比较② 和③ 非金属性强弱的依据是(填序号)。
a.自然界中的含量 b.氢化物的稳定性
c.最高氧化物水化物溶液的酸性 d.单质与酸反应时失去的电子数
Ⅱ.从原子结构的角度解释③ 的非金属性强于②的原因:电子层数相同,核电荷数③ 大于② ,原子半径③②,所以原子核对最外层电子的吸引力③②,得电子能力③大于② 。
(5)⑥的氧化物与③的最高氧化物水化物溶液反应的离子方程式 。