把在空气中久置的铝片5.0 g投入盛有 500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如右的坐标曲线来表示: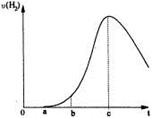
下列推论错误的是
| A.t由0→a段不产生氢气是因为铝的表面存在一层致密的 氧化膜 |
| B.t由b→c段产生氢气的速率增加较快的主要原因之一是 温度升高 |
| C.t=c时反应处平衡状态 |
| D.t>c产生氢气的速率降低主要是因为溶液中c(H+)降低 |
若aXm+与bYn-的核外电子排布相同,下列关系式正确的是
| A.b=a-n+m | B.b=a-n-m |
| C.离子半径Xm+<Yn+ | D.原子半径X<Y |
下列关于物质性质的比较,不正确的是
| A.金属性强弱:Na>Mg>Al | B.酸性强弱:HIO4>HBrO4>HClO4 |
| C.碱性强弱:KOH>NaOH>LiOH | D.原子半径大小:Na>S>O |
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是:
| A.X单质不易与水反应 | B.XO2可被碳或氢气还原为X |
| C.X单质可以导电 | D.XH4的稳定性比SiH4的高 |
下列每组中各物质内既有离子键又有共价键的一组是
| A.NaOH、H2SO4、(NH4)2SO4 | B.MgO、Na2SO4、NH4HCO3 |
| C.Na2O2、KOH、Na2SO4 | D.HCl、Al2O3、MgCl2 |
2008年,美国和俄罗斯科学家将大量48Ca离子加速去轰击人造元素249Cf,从而制造出一种新原子。它的原子核包含118个质子和179个中子。下列有关该元素的叙述正确的是
| A.该元素的相对原子质量为297 | B.这是一种金属元素 |
| C.这是一种原子序数为118的新元素 | D.这是一种主族元素 |