Ⅰ.光合作用是由二氧化碳与水合成葡萄糖,同时放出氧气。设想将该反应倒过来,可设计成一个原电池,产生电流,这样就将太阳能转变成了电能。
(1)写出该原电池的总反应式:______________________________________
(2)写出该电池在酸性介质中放电的电极反应式:
负极:_____________________________________________
正极:_____________________________________________
Ⅱ.类比思维是学习化学的重要方法,但结果是否正确必须经受检验。在进行类比思维的时候,不能机械类比,一定要注意一些物质的特殊性,以防止类比出错误的结论。凭已有的化学知识,下列类比结果正确的是:(填标序号) 。若错误,在其后写出正确的。
①在相同条件下,Na2CO3溶解度比NaHCO3大
类比:在相同条件下,CaCO3溶解度比Ca(HCO3)2大
正确的应该为(若类比正确,此处不写,下同。): 。
②向次氯酸钙溶液中通过量CO2:CO2 + ClO- + H2O = HCO3- + HClO
类比:向次氯酸钠溶液中通过量SO2:SO2 + ClO- +H2O = HSO3- + HClO
正确的应该为: 。
③根据化合价Fe3O4可表示为:FeO·Fe2O3 类比:Fe3I8也可表示为FeI2·2FeI3
正确的应该为: 。
④CaC2能水解:CaC2+2H2O =Ca(OH)2 + C2H2↑
类比:Al4C3也能水解:Al4C3 + 12H2O = 4Al(OH)3↓+ 3CH4↑
正确的应该为: 。
Ⅲ.常温下,某水溶液M中存在的离子有:Na+ 、A-、H+、OH-。若该溶液M由 pH=3的HA溶液
、A-、H+、OH-。若该溶液M由 pH=3的HA溶液 mL与pH=11的NaOH溶液
mL与pH=11的NaOH溶液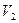 mL混合反应而得,则下列说法中正确的是 (填字母)。
mL混合反应而得,则下列说法中正确的是 (填字母)。
| A.若溶液M呈中性,则溶液M中C(H+)+C(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,则溶液M的pH一定等于7 |
| C.若溶液M呈酸性,则V1一定大于V2 |
| D.若溶液M呈碱性,则V1一定小于V2 |
酚醛树脂可用苯酚和甲醛反应制得。实验室制备酚醛树脂时,在酸性条件下,苯酚过量制得的酚醛树脂若不易取出,则可趁热时加入一些乙醇来取出树脂;在碱性条件下,苯酚过量,若酚醛树脂不易取出时,用加热或加溶剂的方法都很难将树脂取出。在上述两种情况下,下列有关叙述正确的是( )
| A.酸性条件制得的是体型酚醛树脂,碱性条件制得的是线型酚醛树脂 |
| B.酸性条件制得的是线型酚醛树脂,碱性条件制得的是体型酚醛树脂 |
| C.两种条件下制得的都是线型酚醛树脂 |
| D.两种条件下制得的都是体型酚醛树脂 |
硅橡胶是一种耐高温的橡胶,它是由二甲基二氯硅烷经过两种类型的反应而形成的高分子化合物: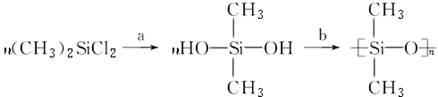
其中反应a得到的产物可看作不稳定的原硅酸(H4SiO4)的二甲基取代物,原硅酸可失水形成较稳定的硅酸。下列说法中不正确的是( )
| A.由上可知原碳酸的化学式是H4CO4 |
| B.HC(OC2H5)3可命名为原甲酸三乙酯 |
| C.反应a和b的类型均属于取代反应 |
| D.反应a和b的类型均不属于取代反应 |
由CH3CH2CH2OH制备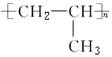 所发生的化学反应至少有( )
所发生的化学反应至少有( )
①取代反应 ②消去反应 ③加聚反应 ④酯化反应
⑤还原反应 ⑥水解反应
| A.①④ | B.②③ |
| C.②③⑤ | D.②④ |
日、美三位科学家因发现“导电聚合物”而荣获2000年诺贝尔化学奖。导电聚合物的结构简式为CH=CH ,其单体为( )
,其单体为( )
| A.乙烯 | B.1,3丁二烯 |
| C.乙炔 | D.乙烷 |
自制胶水的方法之一是将废旧高分子材料切碎后用汽油浸泡一段时间,待其溶解后,即可作胶水使用。下列材料可作该项用途的是( )
| A.硫化橡胶 | B.酚醛树脂 |
| C.聚乙烯塑料 | D.硝酸纤维 |