某探究小组利用丙酮的溴代反应(CH3COCH3+Br2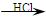 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
| 实验 序号 |
初始浓度c/mol·L-1 |
溴颜色消失 所需时间t/s |
||
| CH3COCH3 |
HCl |
Br2 |
||
| ① |
0.80 |
0.20 |
0.0010 |
290 |
| ② |
1.60 |
0.20 |
0.0010 |
145 |
| ③ |
0.80 |
0.40 |
0.0010 |
145 |
| ④ |
0.80 |
0.20 |
0.0020 |
580 |
分析实验数据所得出的结论不正确的是
| A.增大c(Br2),v(Br2)增大 | B.实验②和③的v(Br2)相等 |
| C.增大c(HCl), v(Br2)增大 | D.增大c(CH3COCH3), v(Br2)增大 |
下列关于原电池的叙述中错误的是
| A.构成原电池的正极和负极必须是两种不同的金属 |
| B.原电池产生电流的实质是电极上进行的氧化还原反应中会有电子的转移 |
| C.在原电池中,电子流出的一极是负极,发生氧化反应 |
| D.原电池放电时,电流的方向是从正极到负极 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
| A.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e一=4OH- |
| B.电解饱和食盐水时,阳极的电极反应式为:2C1-一2e一 =C12↑ |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+ |
| D.钢铁发生电化学腐蚀的正极反应式:Fe一2e—=Fe2+ |
已知:N2(g)+3H2(g) 2NH3(l)△H=﹣132kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
2NH3(l)△H=﹣132kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
| H2(g) |
N2(g) |
NH3(g) |
|
| 1mol分子中的化学键形成时要释放出的能量/kJ |
436 |
946 |
a |
一定条件下,在体积1L的密闭容器中加入1molN2(g)和3molH2(g)充分反应,生成NH3(g)放出热量QkJ,下列说法正确的是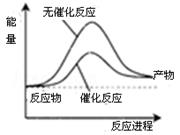
A.上图可表示合成氨过程中的能量变化
B.a的数值为1173
C.Q的数值为92
D.其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量
已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气,放出484 kJ热量,下列热化学方程式正确的是
A.H2O(g)===H2(g)+ O2(g)ΔH=+242 kJ/mol O2(g)ΔH=+242 kJ/mol |
| B.2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ/mol |
C.H2(g)+ O2(g)===H2O(g) ΔH=+242 kJ/mol O2(g)===H2O(g) ΔH=+242 kJ/mol |
| D.2H2(g)+O2(g)===2H2O(g) ΔH=+484 kJ/mol |
下列关于反应热的叙述正确的是
| A.当ΔH<0时,表示该反应为吸热反应 |
B.由C(s)+1/2O2(g) CO(g)的反应热为110.5 kJ·mol-1,可知碳的燃烧热为110.5 kJ·mol-1 CO(g)的反应热为110.5 kJ·mol-1,可知碳的燃烧热为110.5 kJ·mol-1 |
| C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
| D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应放出的热量:CH3COOH<HNO3 |