在25 ℃,101 kPa下,1 mol的白磷(化学式为P4)完全燃烧放出的热量比4 mol的红磷(化学式为P)完全燃烧放出的热量多。反应方程式分别为:P4 (s) + 5O2 (g) = P4O10 (s) ;4P (s)+ 5O2 (g) = P4O10 (s)由此判断,下列说法正确的是
| A.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高 |
| B.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低 |
| C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高 |
| D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低 |
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是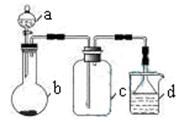
| 选项 |
a中的物质 |
b中的物质 |
c中收集的气体 |
d中的物质 |
| A |
浓氨水 |
CaO |
NH3 |
H2O |
| B |
浓硫酸 |
Na2SO3 |
SO2 |
NaOH溶液 |
| C |
稀硝酸 |
Cu |
NO2 |
H2O |
| D |
浓盐酸 |
MnO2 |
Cl2 |
NaOH溶液 |
下列实验操作中正确的是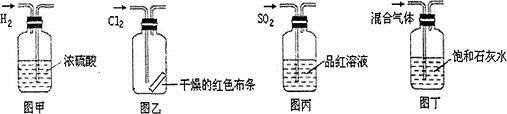
| A.图甲所示,可得到干燥的氢气 |
| B.图乙所示,可以验证氯气的漂白性 |
| C.图丙所示,可以验证SO2的漂白性 |
| D.图丁所示,若石灰水变浑浊,证明混合气体中一定含有CO2 |
能正确表示下列反应的离子方程式是
能正确表示下列反应的离子方程式是
| A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ |
| B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
| C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ |
| D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
下列解释事实的方程式不准确的是