下图是 教师在课堂中演示的两个实验装置(铁架台等辅助仪器略去未画)。
教师在课堂中演示的两个实验装置(铁架台等辅助仪器略去未画)。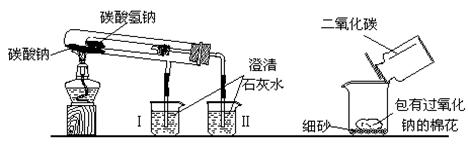
实验一 实验二
回答下列问题:
⑴实验一的实验目的是 ,实验过程中可以看到烧杯中的实验现象是 ,加热过程中发生反应的化学方程式是:  。
。
⑵实验二用来验证Na2O2与CO2的反应,观察到的实验现象是:包有Na2O2的棉花燃烧。从该实验可以得出许多结论,请你写出由该实验得出的两个结论:
结论1: ;
结论2: 。
(12分)铝热反应是铝的一个重要性质。某校化学兴趣小组同学为了克服传统铝热反应纸漏斗易燃烧,火星四射等缺点,将实脸改成以下装置,取磁性氧化铁在如图A实验进行铝热反应,冷却后补到“铁块”混合物.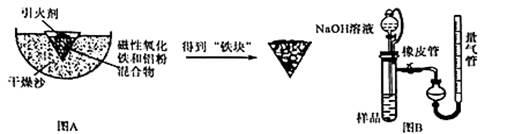
(1)实验中可以用蔗糖和浓硫酸代替镁条作引火剂,共原因是 。
(2)该铝热反应的化学方程式为 。
(3)取反应后的“铁块”研碎取样称量,加入如图B装置,滴入足量NaOH溶液充分反应,测量生成气休体积以测量样品中残留铝的百分含量.试回答下列问题:
①量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为 。
②量气管在读数时必须进行的步骤是 。
③取1g样品进行上述实验,共收集到44.8mL气体(换算成标准状况下),则铝的百分含量为 。
④装置中分液漏斗上端和烧瓶用橡胶管连通,除了可以平衡压强让液体顺利滴入试管之外,还可以起到降低实验误差的作用。如果装置没有橡胶管,测出铝的百分含量将会 (填“偏大”或“偏小”)。
我国制碱工业的先驱 侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓(晶体)依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。
侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓(晶体)依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。
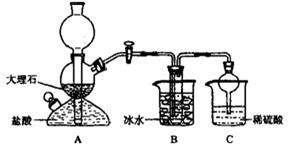
(1)A装置中所发生反应的离子方程式为________。C装置中稀硫酸的作用为_________。
(2)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在装置 之间(填写字母)连接一个盛有 的洗气装置,其作用是 。
(3)过滤NaHCO3时除烧杯、漏斗外,还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的晶体的质量为5.04g,则NaHCO3的产率为 。
已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成。有人提出:CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:通过测量气体的体积判断发生的化学反应,实验装置如下
(1)试剂A可以选用_______,试剂B的作用是_______。
(2)装置E用于测定氧气的体积,请在方框中画出装置图。
(3)实验测得装置C中过氧化钙质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、部分被氧化、完全被氧化的V-m1关系式。
未被氧化:__________,部分被氧化:__________, 完全被氧化:__________。
若SO2完全被氧化,写出反应的化学方程式:__________________。
实验二:向一定量的过氧化钠固体中通入足量SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(4)提出假设:
假设1:反应后固体中只有__________,证明SO2未被氧化;
假设2:反应后固体中只有__________,证明SO2完全被氧化;
假设3:______________。
实验探究:
(5)设计实验,证明假设3是正确的,简要回答实验过程、现象和结论:_______。
实验评价:
(6)实验过程中SO2的通入量直接影响探究实验结果的科学性,请简要说明原因: 。
二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃。用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如下图所示: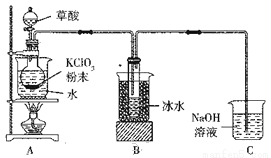
(1)装置A中还应安装的玻璃仪器是 ,装置B用冰水浴的原因是 。
(2)装置A中产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
(3)①实验过程中,装置C中少量的ClO2与NaOH溶液反应产生两种钠盐,且物质的量之比为1:1,其中一种为NaClO2,写出装置C中生成这两种钠盐的离子方程式: 。
②饱和溶液在温度低于38℃时析出晶体NaClO2∙3H2O,在温度高于38℃时析出晶体NaClO2。请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
a. ;b. ;c.洗涤;d.干燥。
(4)还可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备ClO2更受欢迎,其主要原因是 。
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体。如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量, 在滴加稀盐酸的整个过程中HSO3—的物质的量浓度变化趋势为 ;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为 ;此时在B、C两装置中可能观察到的现象为 。
(3)在(2)中滴加足量盐酸后,烧瓶内除Cl—外,还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,然后按以下两种实验方案检验阴离子(X),你认为合理的方案是 (填“甲”或“乙”),请说明另一方案不合理的原因 。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式 。