以下变化是熵减小过程的是
| A.碳酸氢钠受热分解 |
| B.氨气与氯化氢气体反应 |
| C.C(s,石墨)+H2O(g)=CO(g)+H2(g) |
| D.液态水气化 |
下列说法中,正确的是
| A.在化学反应中,发生物质变化的同时不一定发生能量变化 |
| B.催化剂能改变化学反应的平衡转化率 |
| C.△H的大小与热化学方程式中物质的系数无关 |
| D.反应产物的总能量大于反应物的总能量时,△H>0 |
甲烷分子中的4个氢原子都可以被取代。若甲烷分子中的4个氢原子都被苯基取代,则可得到的分子如右图,对该分子的描述,不正确的是: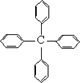
| A.化学式为C25H20 | B.所有碳原子都在同一平面上 |
| C.此分子的一氯代物有三种同分异构体 | D.此物质属烃类物质 |
白酒、食醋、蔗糖、淀粉均为家庭厨房常用的物质,利用这些物质能完成下列实验的是:①检验自来水中是否含氯离子②鉴别食盐和小苏打③蛋壳能否溶于酸④白酒中是否含甲醇
| A.①② | B.①④ | C.②③ | D.③④ |
丙烯酸的结构简式为CH2=CH—COOH,其对应的性质中不正确的是()
| A.与钠反应放出氢气 | B.与新制的Cu(OH)2悬浊液反应 |
| C.能与溴水发生取代反应 | D.发生相互加聚反应 |