下图是关于反应A2(g)+3B2(g)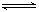 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是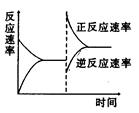
| A.升高温度,同时加压 |
| B.降低温度,同时减压 |
| C.增大反应物浓度,同时减小生成物浓度 |
| D.增大反应物浓度,同时使用催化剂 |
将 4 mol A 气体和 2 mol B 气体在 2 L 的定容容器中混合并在一定条件下发生如下反应 2A(气)+B(气) 2C(气);△H<0 ,经 2 s(秒)后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:
2C(气);△H<0 ,经 2 s(秒)后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
② 达到平衡状态时,升高温度,则该化学平衡向左移动,同时化学平衡常数K也减小;
③ 2 s 时物质 A 的转化率为70%④ 达到平衡状态时,增加A物质的量A和B转化率都提高。⑤当各物质浓度满足c(A)="2c(B)=" c(C)时,该反应达到了平衡状态;其中正确的是()
A.①③B. ①②C. ②③D. ③④
下列物质的化学用语正确的是
①NH4H的电子式
②硝基苯的结构简式:
③葡萄糖的实验式:CH2O
④甲烷分子的比例模型:
⑤Fe2+的离子结构:
⑥原子核内有10个中子的氧原子:
⑦sp2杂化轨道模型:
| A.②③⑤ | B.①③⑤⑥ | C.③⑥⑦ | D.②③⑥⑦ |
温家宝总理在2010年政府工作报告中提出,推广高效节能技术,提倡低碳生活,积极发展新能源和可再生能源。下列有关做法与此不相符的是( )
| A.大力开发丰富的煤炭资源,减少对石油的依赖 |
| B.在西部和沿海地区兴建风力发电站,解决能源问题 |
| C.世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济 |
| D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |
已知:CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41kJ/mol相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
| 容器 编号 |
起始时各物质物质的量/mol |
达平衡过程体系 |
|||
| CO |
H2O |
CO2 |
H2 |
能量的变化 |
|
| ① |
1 |
4 |
0 |
0 |
放出热量:32.8 kJ |
| ② |
0 |
0 |
1 |
4 |
热量变化:Q |
下列说法中,不正确的是()
A.容器①中反应达平衡时,CO的转化率为80%
B.容器②中吸收的热量O为32.8 kJ
C.平衡时,两容器中CO2的浓度相等
D.容器①中当CO反应速率等于H2O的反应速率时,反应可能达到平衡
有4种混合溶液,分别由等体积0.1 mol·L﹣1的两种溶液混合而成,①NH4Cl与CH3COONa
②NH4Cl与HCl③NH4Cl与NaCl④NH4Cl与NH3·H2O(混合液呈碱性)。下列各项排序正确的是()
| A.pH:②<①<③<④ |
| B.c(NH4+):①<③<②<④ |
| C.溶液中c(H+):①<③<②<④ |
| D.c(NH3·H2O):①<③<④<② |