某化工厂联合生产纯碱、镁、阻燃剂。以白云石(CaCO3·MgCO3)为原料冶炼镁:经高温煅烧生成的氧化物在还原炉中经1200℃用硅铁还原生成镁蒸汽(铁化合价不变),镁蒸汽经冷凝为粗镁;同时以海水为原料制碱和制阻燃剂。具体流程如下: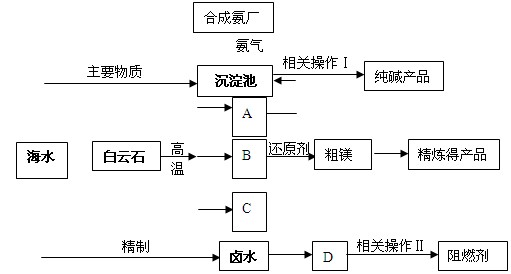
(1)分别写出A、B、C的化学式 、 、 ;沉淀池中反应的化学方程式是 。
(2)硅铁还原生成镁蒸汽时选择低压和1200℃,试分析选择这种反应条件的原因
。
(3)精制卤水中的MgCl2与适量石灰乳反应生成碱式氯化镁[Mg(OH)Cl]沉淀,此时溶液中主要溶质是(写化学式) 。
(4)描述流程中相关操作Ⅰ包括过滤、 、 。
(5)已知:Mg(OH)2(s)→MgO(s)+H2O(g)-81.5kJ;Al(OH)3(s)→0.5Al2O3(s)+1.5 H2O(g)-87.7kJ
①Mg(OH)2能起阻燃作用,其原因是 。
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是 。
(6)某化工厂利用上图所示流程联合生产纯碱、镁、阻燃剂,试分析该生产的优点
。
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素B、C、D的第一电离能的由大到小排列顺序为。(用元素符号表示)
(2)D元素原子的最外层电子排布图为。
(3)该配位化合物的化学式为,配体的中心原子的杂化方式为。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为。
(5)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为,分子中含有个s键,个p键。
(6)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的 化学式为。该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式。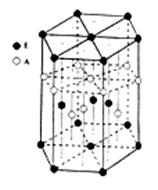
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理, 回答下列问题: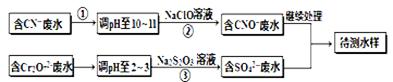
(1)上述处理废水流程中主要使用的方法是。
(2)②中反应后无气体放出,该反应的离子方程式为。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液, 蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于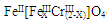 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4•7H2O,下列结论正确的是。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4•7H2O,下列结论正确的是。
| A.x ="0.5" ,a =8 | B.x ="0.5" ,a = 10 | C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |
已知A、B、C、D、E、X存在下图示转化关系(部分生成物和反应条件略)。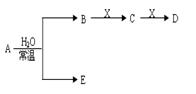
(1)若E为,则A与水反应的化学方程式。表示X溶液呈碱性的离子方程式为,用结构式表示C分子:。
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为。
(2)若E为常见单质气体,D为白色胶状沉淀,A的化学式可能是,B中含有的化学键类型为,C与X反应的离子方程式为。
(3)若A、B均为气体单质,D可与水蒸气在一定条件下发生可逆反应生成C和一种可燃性气体单质,则该可逆反应的化学方程式为。t℃时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的化学平衡常数K=1,则D的转化率为。
(15分)I.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题: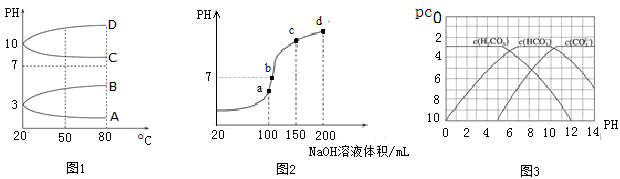
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+)(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH4+)。
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是(填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=mol·L-1(填数值)。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。
试分析图中a、b、c、d四个点,水的电离程度最大的是;在b点,溶液中各离子浓度由大到小的排列顺序是。
II.pC是指极稀溶液中溶质物质的量浓度的常用对数负值, 类似pH。如某溶液溶质的浓度为1×10-3 mol·L-1,则该溶液中该溶质的pC=-lg10-3=3。已知H2CO3溶液中存在下列平衡:CO2+H2O H2CO3 H2CO3
H2CO3 H2CO3 H++HCO3- HCO3-
H++HCO3- HCO3- H++CO32-
H++CO32-
图3为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图。请回答下列问题:
(1)在pH=9时,H2CO3溶液中浓度最大的含碳元素的离子为。
(2)pH<4时,溶液中H2CO3的pC总是约等于3的原因是。
(3)已知M2CO3为难溶物,则其Ksp的表达式为;现欲将某溶液中的M+以碳酸盐(Ksp=)的形式沉淀完全,则最后溶液中的CO32-的pC最大值为(溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全)。
实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案: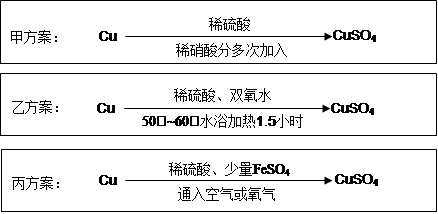
请回答有关问题:
(1)甲方案:
①写出该反应的离子方程式;
②为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H2SO4):n(HNO3)=。
(2)乙方案:将6.4g铜丝放到90mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入40mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO4·5H2O 20.0g【已知有关摩尔质 量:M(Cu)=64g/mol, M(CuSO4·5H2O) =250g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是;
②本实验CuSO4·5H2O的产率为。
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
①物质A可选用以下的(填序号);
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E.Fe2(SO4)3 |
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是;
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条):
、。