分类是重要的科学研究方法,下列物质归类不正确的是
| A.混合物:水煤气、石油裂解气、漂粉精、铝热剂 |
| B.电解质:明矾、石墨、冰醋酸、硫酸钡 |
| C.化合物:干冰、烧碱、冰水混合物、胆矾 |
| D.能用启普发生器或其简易装置制取的有 |
下列各组离子在溶液中能够大量共存,当溶液中c(OH-)=10-13mol/L 时,有气体产生,而当溶液中c(H+)=10-13mol/L时,又能产生沉淀。则该组离子可能是
| A.Fe2+、Na+、SO42-、NO3- | B.NO3-、Ca2+、H+、HCO3- |
| C.Cu2+、NH4+、SO42-、Cl- | D.Ba2+、K+、Cl-、NO3- |
下列叙述正确的是
| A.利用惰性电极电解饱和食盐水的过程中,溶液中水的电离平衡向左移动 |
| B.溴元素和碘元素被称为“海洋元素” |
| C.向AlCl3溶液中加入氨水可制取Al(OH)3 |
| D.Fe分别与氯气和稀盐酸反应可得到同一种氯化物 |
化学与生产、生活和科技关系密切,下列叙述错误的是
| A.手机上用的锂离子电池属于二次电池 |
| B.向海水中加净水剂明矾可以使海水淡化 |
| C.氮的固定是指空气中游离态氮转化为化合态的过程 |
| D.食盐水和淀粉溶液可以通过丁达尔现象实验进行鉴别 |
实验室用0.10mol/L的NaOH溶液滴定某一元弱酸HA的滴定曲线如图所示。图中横轴为滴入的NaOH溶液的体积V(mL),纵轴为溶液的pH。下列叙述不正确的是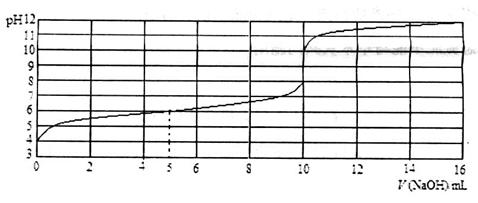
A.此一元弱酸HA的电离平衡常数Ka≈1×10-6mol/L
B.此弱酸的起始浓度约为1×10-2mol/L
C.此实验最好选用酚酞试液(变色范围8.0~10.0)做指示剂
D.当混合液pH=7时,溶液中c(HA)>c(A—)
关于下列各装置图的叙述中,正确的是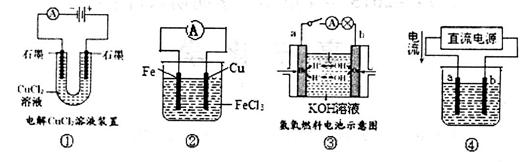
| A.装置①阳极有红色物质析出 |
| B.装置②的总反应为Cu+2Fe3+=Cu2++2Fe2+ |
| C.装置③中a为负极,发生的电极反应式为H2+2OH-—2e-=2H2O |
| D.用装置④精炼铜,则a极为纯铜,电解质溶液可为CuSO4溶液 |