以下反应中,Q1 >Q2的是
A.S(s)+O2(g)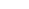 → SO2(g)+ Q1 kJ; S(g)+O2(g) → SO2(g)+ Q1 kJ; S(g)+O2(g)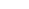 → SO2(g)+ Q2kJ → SO2(g)+ Q2kJ |
B.2H2(g)+O2(g)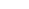 → 2H2O(l)+Q1 kJ ;2H2(g)+O2(g) → 2H2O(g)+Q2 kJ → 2H2O(l)+Q1 kJ ;2H2(g)+O2(g) → 2H2O(g)+Q2 kJ |
C.NaOH(aq)+HCl(aq)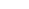 → NaCl(aq)+H2O(l)+Q1 kJ → NaCl(aq)+H2O(l)+Q1 kJNaOH(aq)+CH3COOH(aq) →CH3COONa(aq)+H2O(l)+Q2 kJ |
D.H2(g)+Cl2(g)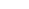 → 2HCl(g)+Q1 kJ, H2(g)+F2(g) → 2HCl(g)+Q1 kJ, H2(g)+F2(g)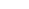 → 2HF(g)+Q2 kJ → 2HF(g)+Q2 kJ |
下列有关化学研究的说法正确的是()
| A.利用丁达尔效应可用来区分溶液与胶体,这是一种常用的化学方法 |
| B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 |
| C.Mg和Al属于活泼的金属,均可用通过电解熔融的MgCl2和AlCl3来制取 |
| D.研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展 |
化学与工农业生产、生活和社会密切相关,下列说法中不正确的是()
| A.开发太阳能、水能、风能等新能源、减少使用煤、石油等化石燃料 |
| B.陶瓷、玻璃、水泥等是使用量最大的无机非金属材料 |
| C.氢氧燃料电池、铅蓄电池、硅太阳能电池中都利用了原电池原理 |
| D.Fe2O3俗称铁红,常用作红色油漆和涂料 |
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是( )
A.根据图①可判断可逆反应A2(g)+3B2(g)  2AB3(g)的△H>O 2AB3(g)的△H>O |
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙曲线表示的压强大 3C(g)+D(s)的影响,乙曲线表示的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.室温时,CaC03在水中的沉淀溶解平衡曲线如图④所示,c点时有CaC03生成 |
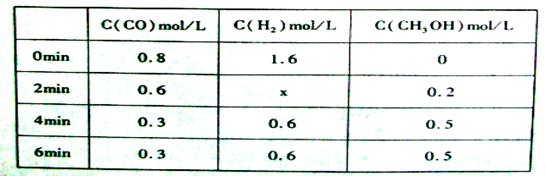
在容积固定的容器中发生反应:CO(g)+2H2(g) CH3OH(g) △H<0,各物质的浓度如下表下列说法不正确的是( )
CH3OH(g) △H<0,各物质的浓度如下表下列说法不正确的是( )
| A.2min-4min内用氢气表示的速率为0.3mol/(L•min) |
| B.达平衡时,CO的转化率为62.5% |
C.反应在第2m in时改变了条件,可能是加入了催化刺 in时改变了条件,可能是加入了催化刺 |
| D.反应在第2min时改变了条件,可能增加了H2的浓度 |
观察下列几个装置示意图,有关叙述正确的是( )
| A.装置①中阳极上析出红色固体 |
| B.装置②的待镀铁制品应与电源正极相连 |
| C.装置③闭合电键后,外电路电子由a极流向b极 |
| D.装置④的x电极是外接电源的正极 |