下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是
| A.曲线A表示将足量的CO2不断通入KOH、KAlO2的混合溶液中,生成沉淀的物质的量与通入CO2体积的关系示意图 |
| B.曲线B是向澄清石灰水中通入CO2至过量 |
| C.曲线C是向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 |
| D.曲线D是向含有等物质的量的Ca(OH)2、KOH溶液中通入CO2至过量 |
下列判断中正确的是
| A.烧杯a中的溶液pH升高 | B.锌是化学电源的正极 |
| C.烧杯a中发生的反应为2H++2e-=H2↑ | D.盐桥中的阳离子向铁电极移动 |
工业上制取碘酸钾的反应为:I2+2KClO3===2KIO3+Cl2,下列叙述正确的是
| A.氧化性:I2>Cl2 | B.每生成1 mol KIO3转移电子5mol |
| C.该反应是置换反应 | D.反应物和生成物中只含有共价键 |
在容积不变的密闭容器中存在如下反应: 2SO2(g)+O2(g) 2SO3(g);△H<0,
2SO3(g);△H<0,
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是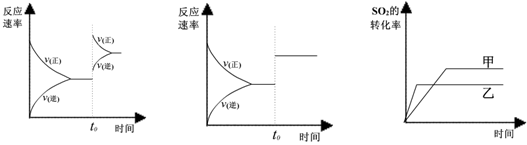
Ⅰ IIIII
| A.图I研究的是t0时刻增大O2的浓度对反应速率的影响 |
| B.图II研究的是t0时刻加入催化剂后对反应速率的影响 |
| C.图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高 |
| D.图III研究的是温度对化学平衡的影响,且乙的温度较低 |
一种新型净水剂PAFC{聚合氯化铁铝,[AlFe(OH)nCl6-n]m,n<5,m<10},广泛用于生活用水的净化和废水的净化,有关PAFC的说法正确的是
| A.PAFC用于净化饮用水时,可以除去水中所有的有害物质 |
| B.PAFC中铁显+2价 |
| C.PAFC可看做一定比例的氯化铝和氯化铁的水解产物 |
| D.PAFC在强酸性或强碱性溶液中都能稳定存在 |
已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
Hg(l)+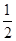 O2(g)=HgO(s) △H=-90.8kJ·mol-1
O2(g)=HgO(s) △H=-90.8kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
| A.-259.7 kJ·mol-1 | B.+259.7 kJ·mol-1 |
| C.+519.4kJ·mol-1 | D.-519.4kJ·mol-1 |