下表为周期表前20号元素中某些元素的有关数据:
| 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
原子半径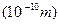 |
1.86 |
1.52 |
0.66 |
1.43 |
0.77 |
1.10 |
0.99 |
2.31 |
0.70 |
0.64 |
| 最高价态 |
+1 |
+1 |
—— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
—— |
| 最低价态 |
—— |
—— |
-2 |
—— |
-4 |
-3 |
-1 |
—— |
-3 |
-1 |
试回答下列问题:(以下各题回答,可能的话,均用对应的元素符号或物质的化学式表示)
(1)写出⑦⑨与氢元素形成的常见离子化合物的电子式
(2)上述⑤、⑥、⑦号元素中某2种元素形成的化合物中,每一个原子都满足最
外层为8电子稳定结构的物质可能是 、 ;
(3)某元素R的原子半径为1.04×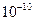 m,该元素在周期表中的位置是
m,该元素在周期表中的位置是
(4)以上10种元素的原子中,失去核外第一个电子所需能量最少的是
(5)④、⑦、⑧、⑩四种元素形成的离子,其半径由小到大的顺序为
(12分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为__________;
(2)写出与H2O分子互为等电子体的微粒__________(填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是_____
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_____(请用相应的编号填写)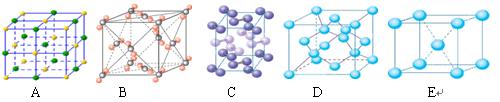
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:。
m、n、x、y四种主族元素在周期表里的相对位置如下图所示。已知它们的原子序数总和为46,则:
(1)元素n的气态氢化物的分子式为,空间构型为。
(2)m与y所形成的化合物含键,属分子。(填“极性”或“非极性”)
(3)x位于周期表的第周期,第族;其原子结构示意图为。
(4)由n、y的氢化物相互作用所生成的物质的电子式为,此物质在固态时属于晶体。
(7分)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是_________。
(2)写出C元素基态原子的电子排布式_________________________。
(3)用轨道表示式表示D元素原子的价电子构型____________________。
(4)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填“>”、“<”或“=”)
A、B、C、D四种短周期元素,0.5molA元素的离子得到的6.02×1023个电子后被还原为中性原子;0.4克A的氧化物恰好与100mL 0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等。A元素原子核外电子数比B元素原子核外电子数多1;C - 离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)推断A、B、C、D四种元素的符号A_____;B____;C______;D_____。
(2)C的一价阴离子的结构示意图_____________________;
(3)D元素的最高价氧化物的结构式是:_______________;
(4)C、D两元素形成的化合物电子式 _____________,分子内含有_________键(填“极性”或“非极性”)。
(5)用电子式表示A、C两元素形成的化合物的过程:
______________________________________________________________。
(6)写出A的最高价氧化物对应水化物与C的最高价氧化物对应水化物反应的化学方程式:
用电子式表示下列过程:
①NaCl的形成过程____________________________________________
② H2O的形成过程____________________________________________