由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用下图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀。已知两极材料分别为石墨和铁: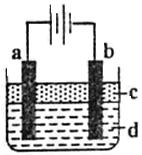
(1)a极材料为 ,a电极反应式为 。
(2)电解液d可以是 ,则白色沉淀在电极上生成;电解液d也可以是 ,则白色沉淀在两极间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是 ,在加苯之前对d溶液进行加热煮沸处理,目的是 。
(4)为了在短时间内看到白色沉淀,可以采取的措施是 。
A.改用H2SO4作电解液 B.适当增大电源电压
C.适当缩小两极间距离 D.适当地降低电解液的温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源继续电解,除了电极
上看到的气泡外,另一明显的现象为 。
按要求书写下列离子方程式或化学方程式:
①写出Ba(NO3)2溶液中加稀H2SO4的离子方程式:。
②写出将铁屑加入CuSO4溶液中的离子方程式:。
③将Cu2++2OH-=Cu(OH)2↓改写成化学反应方程式:。
④将CO32-+2H+=CO2↑+H2O改写成一个化学反应方程式:。
写出与下列每一个离子方程式对应的一个化学反应方程式:
(1)CO32-+2H+=H2O+CO2↑:。
(2)H++OH-=H2O:。
(3)Mg+2H+=Mg2++H2↑:。
(4)BaCO3+2H+=Ba2++H2O+CO2↑:。
有下列离子:K+、Mg2+、Ba2+、Na+、SO2-4、OH-、NO-3、Cl-等。按其在溶液中可大量共存的原则,将上述离子等分成两组(要求每组不少于两种阳离子和两种阴离子),则两组分别是______________________________,__________________________。
往平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H2O ]与氯化铵[NH4Cl]晶体,塞紧瓶塞。在木板上滴少量水,如下图所示。一会儿,就发现瓶内固态物质变成液体,瓶塞变冷,小木板上因少量水冻结而把烧瓶粘住,这时打开瓶塞,放出的气体有氨气的气味。这是自发的发生了吸热反应:。这个现象说明下列结论正确的是
| A.自发反应一定是吸热反应 | B.自发反应一定是放热反应 |
| C.有的吸热反应也能自发进行 | D.吸热反应不能自发进行 |

汽车尾气中的主要污染物是及燃料不完全燃烧所产生的。前者产生的原因是(用化学方程式表示)。经计算,反应2NO (g)+2CO(g)=N2(g)+2CO2(g)的△H-T△S<0,即这一反应应该是自发进行的,为什么常温常压下大气中的NO和CO不能转化为N2和CO2而净化?
。