下列反应的离子方程式正确的是
A.Fe(OH)2溶于足量氯水:Fe(OH)2 + 2H+= Fe2++ 2H2 O O |
B.有机物A与足量NaOH溶液共热: 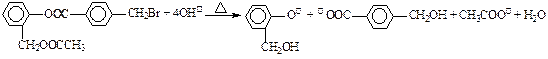 |
| C.碳酸钠固体加入盐酸:Na2CO3 + 2H+= 2Na++ 2H2O + CO2↑ |
| D.NaAlO2溶液与KHCO3溶液混合:AlO2-+ HCO3-+ H2O = Al(OH)3↓+ CO32- |
设NA为阿伏加德罗常数,下列说法中正确的是( )。
| A.4mol浓盐酸与足量MnO2充分反应生成Cl2分子1NA |
| B.在25℃ 101kPa中,44.8 L14CO2中碳元素含有中子数16 NA |
| C.已知Fe3O4 + 4CO = 4CO2 + 3Fe,当生成168g Fe时转移的电子数是6NA |
| D.某中子数为18的34X2-微粒共1mol,其中共有电子数为 18NA |
用自来水养金鱼时,通常先将自来水经日晒一段时间后,再注入鱼缸,其目的是( )
| A.利用紫外线杀死水中的细菌 | B.提高水温,有利于金鱼生长 |
| C.增加水中氧气的含量 | D.促使水中的次氯酸分解 |
下列不属于传统硅酸盐产品的是()
| A.玻璃 | B.水泥 | C.光导纤维 | D.陶瓷 |
某结晶水合物的化学式为R•nH2O,其相对分子质量为M。25℃时,将a g该晶体溶于b g H2O中恰好形成V mL饱和溶液。下列表达式正确的是 ( )
A.饱和溶液物质的量浓度为: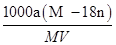 1000 a(M -18n) mol/L 1000 a(M -18n) mol/L |
B.饱和溶液溶质的质量分数为: |
C.25℃时R的溶解度为: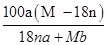 g/100 g H2O g/100 g H2O |
D.饱和溶液的密度为: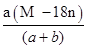 g/mL g/mL |
今有一混合物的水溶液,只可能肯有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀生成;
(2)第二份加足量NaOH溶液后,收集到气体0.05mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀4.3g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测正确的是 ( )
| A.K+可能存在 | B.混合溶液中c(CO32-)为1 mol/L |
| C.Cl-一定存在 | D.Ba2+一定不存在,Mg2+可能存在 |